- Склад
- Лікарська форма
- Фармакотерапевтична група
- Фармакологічні властивості
- Клінічні характеристики
- Показання
- Протипоказання
- Взаємодія з іншими засобами
- Особливості застосування
- У період вагітності
- При керуванні автомобілем
- Спосіб застосування та дози
- Діти
- Передозування
- Побічні реакції
- Термін придатності
- Умови зберігання
- Упаковка
- Категорія відпуску
- Виробник
- Місцезнаходження виробника
Теравас інструкція із застосування
Офіційна інструкція лікарського засобу Теравас таблетки 250 мг, 500 мг. Опис та застосування Teravas, аналоги та відгуки. Інструкція Теравас таблетки затверджена виробником.
Склад
діюча речовина:
1 таблетка містить дівалпроекс натрію у перерахуванні на вальпроєву кислоту 250 мг або 500 мг;
допоміжні речовини:
таблетки пролонгованої дії по 250 мг: целюлоза мікрокристалічна; лактоза, моногідрат; гіпромелоза; гідроксіетилцелюлоза; кремнію діоксид; плівкова оболонка Opadry white OY- 58900 (склад оболонки: гіпромелоза, титану діоксид (Е 171), поліетиленгліколь);
таблетки пролонгованої дії по 500 мг: целюлоза мікрокристалічна; лактоза, моногідрат; гіпромелоза; гідроксіетилцелюлоза; кремнію діоксид; плівкова оболонка Opadry grey 20А57646 (склад оболонки: гідроксипропілцелюлоза, гіпромелоза, титану діоксид (Е 171), заліза оксид чорний (Е 172), заліза оксид жовтий (Е 172)).
Лікарська форма
Таблетки пролонгованої дії.
Основні фізико-хімічні властивості:
таблетки пролонгованої дії по 250 мг: білі або майже білі, округлої форми зі скошеним краєм, двоопуклі вкриті оболонкою таблетки з тисненням «R» на одній стороні та «533» — на іншій;
таблетки пролонгованої дії по 500 мг: сірі, овальної форми зі скошеним краєм, двоопуклі вкриті оболонкою таблетки з тисненням «R» на одній стороні та «534» — на іншій.
Фармакотерапевтична група
Протиепілептичні засоби.
Код ATX N03A G01.
Фармакологічні властивості
Фармакодинаміка.
Механізм дії
У шлунково-кишковому тракті дівалпроекс натрію розпадається на іони вальпроату. Механізмів, за допомогою яких вальпроат здійснює терапевтичний ефект, не встановлено. Є припущення, що його активність при епілепсії пов’язана з підвищенням концентрації гамма- амінобутирової кислоти (ГАБК) у мозку.
Взаємозв’язок між концентрацією у плазмі крові та клінічною відповіддю не підтверджений. Одним із факторів є нелінійне, залежне від концентрації зв’язування вальпроату з білками, яке впливає на кліренс лікарського засобу. Таким чином, моніторинг загальної кількості вальпроату у плазмі крові не може забезпечити надійного показника біологічно активних видів вальпроату.
Оскільки зв’язування вальпроату з білками плазми крові залежить від концентрації, вільна фракція збільшується приблизно від 10% при 40 мкг/мл до 18,5% при 130 мкг/мл. Більш високі за очікувані вільні фракції виявляються у людей літнього віку, у пацієнтів з гіперліпідемією та у пацієнтів із хворобами печінки та нирок.
Епілепсія
Терапевтичним діапазоном при епілепсії загалом вважається 50—100 мкг/мл загального вальпроату, проте у деяких пацієнтів вдається досягти контролю над терапевтичним ефектом при нижчій або вищій концентрації у плазмі крові.
Маніакальний синдром
У плацебо-контрольованих клінічних дослідженнях гострого маніакального синдрому у пацієнтів було досягнуто клінічної відповіді при залишкових концентраціях препарату у плазмі крові у межах від 85 до 125 мкг/мл.
Фармакокінетика.
Абсорбція/біодоступність
Абсолютна біодоступність дівалпроекс натрію, таблетки пролонгованої дії у вигляді одноразової дози після прийому їжі становила приблизно 90% відносно внутрішньовенної інфузії.
За умови прийому однакових загальних добових доз біодоступність дівалпроекс натрію, таблетки пролонгованої дії є меншою, ніж у дівалпроекс натрію, таблетки з модифікованим вивільнення. Прийом дівалпроекс натрію, таблетки пролонгованої дії 1 раз на добу натщесерце та після їжі призводив до середньої біодоступності 89% відносно аналогічної загальної добової дози дівалпроекс натрію, таблетки з модифікованим вивільнення, призначеного для дво-, три- та чотириразового прийому на добу. Середній час досягнення максимальної плазмової концентрації вальпроату (Сmах) після прийому дівалпроекс натрію, таблетки пролонгованої дії становив від 4 до 17 годин. Після кількох прийомів дівалпроекс натрію, таблетки пролонгованої дії у режимі 1 раз на добу коливання між максимальною та мінімальною концентраціями вальпроату у плазмі крові було на 10—20% нижчим, ніж при регулярному прийомі доз дівалпроекс натрію, таблетки з модифікованим вивільнення, призначених для дво-, три- та чотириразового прийому на добу.
Розподіл
Зв ‘язування з білками
Зв’язування вальпроату з білками плазми залежить від концентрації, а вільна фракція збільшується приблизно від 10% при концентрації 40 мкг/мл до 18,5% при 130 мкг/мл відповідно. Зв’язування білків з вальпроатом зменшується у людей літнього віку, у пацієнтів із хронічними захворюваннями печінки, у пацієнтів із порушеннями функції нирок та під час прийому інших лікарських засобів (наприклад, аспірину). І навпаки, вальпроат може витісняти певні лікарські засоби, що зв’язуються з білками (наприклад, фенітоїн, карбамазепін, варфарин і толбутамід).
Розподіл у ЦНС
Концентрація вальпроату у спинномозковій рідині (СМР) наближається до концентрації незв’язаного вальпроату у плазмі крові (приблизно 10% від загальної концентрації).
Метаболізм
Вальпроат майже повністю метаболізується у печінці. У дорослих пацієнтів при монотерапії 30—50% введеної дози виявляється в сечі у вигляді глюкуронідного кон’югату. Інший основний шлях метаболізму — мітохондріальне р-окислення, на яке зазвичай припадає понад 40% дози. Як правило, менше 15—20% дози елімінується за допомогою інших окислювальних механізмів. Менше 3% введеної дози екскретується у незміненому вигляді в сечу.
Співвідношення між дозою та загальною концентрацією вальпроату є нелінійним; концентрація не збільшується пропорційно до дози, а, швидше, збільшується меншою мірою завдяки насиченому зв’язуванню з білками плазми крові. Кінетика незв язаного лікарського засобу є лінійною.
Елімінація
Середній плазмовий кліренс і об’єм розподілу загальної дози вальпроату становить 0,56 л/год/1,73 м2 і 11 л/1,73 м2 відповідно. Середній плазмовий кліренс та об’єм розподілу вільної фракції вальпроату становить 4,6 л/год/1,73 м2 і 92 л/1,73 м . Середній кінцевий період напіввиведення вальпроату у режимі монотерапії становив від 9 до 16 годин після перорального прийому від 250 до 1000 мг.
Наведені дані застосовуються, перш за все, для пацієнтів, які не приймають лікарські засоби, що впливають на ферментні системи печінкового метаболізму. Наприклад, у пацієнтів, котрі приймають ферментно-стимулюючі протиепілентичні лікарські засоби (карбамазепін, фенітоїн та фенобарбітал), спостерігається більш швидке виведення вальпроату. У зв’язку з такими змінами у процесі кліренсу вальпроату є доцільним посилення моніторингу концентрацій препарату у плазмі крові щоразу, коли до лікування додаються або відміняються інші протиепілептичні препарати.
Окремі групи пацієнтів.
Пацієнти літнього віку
Спроможність пацієнтів літнього віку (віковий діапазон: 68—89 років) щодо елімінації вальпроату знижується порівняно з дорослими пацієнтами молодшого віку (віковий діапазон: 22—26 років). Власний кліренс зменшується на 39%; вільна фракція збільшується на 44%. Таким чином, у пацієнтів літнього віку є доцільним зменшення першої дози препарату.
Гендерний вплив
Жодних відмінностей показників «площа поверхні тіла відносно незв’язаного кліренсу» у чоловіків та жінок (4,8 ± 0,17 і 4,7 ± 0,07 л/год на 1,73 м2 відповідно) не виявлено.
Вплив расової приналежності
Вплив раси на кінетику вальпроату не вивчали.
Захворювання печінки
Захворювання печінки погіршують здатність організму виводити вальпроат. За даними одного дослідження кліренс вільного вальпроату був знижений на 50% у пацієнтів із цирозом печінки та на 16% у 4 пацієнтів на гострий гепатит порівняно зі здоровими добровольцями. У даному дослідженні період напіввиведення вальпроату зріс з 12 до 18 годин. Хвороби печінки також пов’язані зі зниженням концентрації альбуміну та збільшенням незв’язаних фракцій вальпроату (збільшення у 2—2,6 раза). Відповідно, моніторинг загальних концентрацій може бути хибним, оскільки у пацієнтів із захворюваннями печінки вільні концентрації можуть бути істотно підвищеними, тоді як загальна концентрація може виявитися у межах норми.
Захворювання нирок
У пацієнтів із нирковою недостатністю (кліренс креатиніну <10 мл/хв) спостерігалося незначне зниження (27%) у кліренсі незв’язаного вальпроату; проте гемодіаліз зазвичай знижує концентрацію вальпроату приблизно на 20%. Тому у випадку пацієнтів із нирковою недостатньою немає необхідності у корекції дози. Зв’язування білків у таких пацієнтів істотно знижується; таким чином, моніторинг загальної концентрації може бути хибним.
Клінічні характеристики
Теравас Показання
Маніакальний синдром
Лікування гострих маніакальних та змішаних епізодів, пов’язаних з біполярним розладом, із психотичними проявами або без них.
Епілепсія
Монотерапія та допоміжна терапія при лікуванні дорослих пацієнтів та дітей віком від 10 років при складних парціальних нападах, які виникають окремо або у зв’язку з іншими видами судом. Лікарський засіб також показаний у якості монотерапії та допоміжної терапії при лікуванні простих та складних абсансів у дорослих пацієнтів та дітей віком від 10 років і старше, а також у якості допоміжної терапії при лікуванні дорослих пацієнтів та дітей віком від 10 років і старше з різними типами нападів, які включають абсанси.
Мігрень
Профілактика мігренеподібного головного болю.
Протипоказання
Захворювання печінки або значна дисфункція печінки.
Підвищена чутливість до натрієвої солі вальпроєвої кислоти або будь-якого іншого компонента лікарського засобу (див. розділ «Склад»).
Пацієнти з відомими розладами циклу утворення сечовини.
Для профілактики мігренеподібного головного болю у вагітних жінок або жінок, які планують завагітніти (див. розділ «Застосування у період вагітності або годування груддю»).
Жінкам репродуктивного віку, які не користуються ефективними засобами контрацепції, за винятком випадків, коли такий препарат є важливим для контролю стану їх здоров’я.
Відомі мітохондріальні розлади, що спричинені мутаціями у мітохондріальній ДНК гамма- полімерази (POLG; наприклад, синдром Альперса-Гуттенлохера).
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Вплив одночасно введених лікарських засобів на кліренс вальпроату
Лікарські засоби, які впливають на рівень експресії печінкових ферментів, зокрема ті, що підвищують рівні глюкуронозилтрансферази (наприклад, ритонавір), можуть. збільшити кліренс вальпроату. Наприклад, фенітоїн, карбамазепін і фенобарбітал (або примідон) аджта подвоювати кліренс вальпроату. Таким чином, у пацієнтів, які отримують лікування у режимі монотерапії, як правило, триваліший період напіврозпаду та більш високі концентрації порівняно з пацієнтами, які отримують, політерапію протиепілептичними лікарськими засобами.
Навпаки, можна очікувати, що препарати, які є інгібіторами ізоферментів цитохрому Р450, наприклад, антидепресанти, мало впливають на кліренс вальпроату, оскільки мікросомальне опосередковане окислення цитохрому Р450 є відносно незначним вторинним метаболічним шляхом порівняно з глюкуронідацією та бета-окисленням.
Через ці зміни у процесі кліренсу вальпроату є доцільним збільшення моніторингу концентрації вальпроату та супутніх лікарських засобів, коли призначають або відміняють фермент-індукуючі лікарські засоби.
Наступний список містить інформацію про можливий вплив декількох загальноприйнятих лікарських засобів на фармакокінетику вальпроату. Цей список не є вичерпним і не може таким бути, оскільки постійно з’являються повідомлення про нові взаємодії.
Аспірин
Дослідження, що включало одночасне застосування аспірину у жарознижувальних дозах (11-16 мг/кт) з вальпроатом у дітей, виявило зниження зв’язування з білками та інгібування метаболізму вальпроату. Вільна фракція вальпроату збільшувалась у 4 рази у разі супутнього прийому ацетилсаліцилової кислоти порівняно з прийомом одного тільки вальпроату. Шлях В- окислення, що складається з 2-Е-вальпроєвої кислоти, З-ОН-вальпроєвої кислоти та 3- кетовальпроєвої кислоти, знижувався з 25 % від загальної кількості виведених метаболітів у разі наявності одного вальпроату до 8,3 % у разі наявності аспірину. Незалежно від того, чи відомо про зафіксовану у ході даного дослідження взаємодію у дорослих, слід дотримуватися обережності при одночасному застосуванні вальпроату та аспірину.
Антибіотики групи карбапенемів
Клінічно значуще зниження рівня концентрації вальпроєвої кислоти у сироватці крові спостерігається у пацієнтів, які приймають антибіотики групи карбапенемів (наприклад, ертапенем, іміпенем, меропенем та ін.), що може призвести до втрати контролю над нападами. Механізм даної взаємодії не досліджений. Слід часто контролювати концентрацію вальпроєвої кислоти у сироватці крові після початку прийому карбапенему. У разі суттєвого зниження концентрації вальпроєвої кислоти у плазмі крові чи погіршенні контролю над нападами слід розглянути альтернативну антибактеріальну або протисудомну терапію.
Естрогеновмісні гормональні контрацептиви
Естрогеновмісні гормональні контрацептиви можуть збільшувати кліренс вальпроату, що може призвести до зменшення концентрації вальпроату та, можливо, збільшення частоти нападів. Лікарі, які призначають лікування, мають контролювати концентрацію вальпроату у сироватці крові та клінічну відповідь при призначенні або відміні лікарських засобів, що містять естроген.
Фелбамат
У дослідженні, що включало одночасне застосування фелбамату з вальпроатом у дозі 1200 мг/добу у пацієнтів з епілепсією, було виявлено збільшення середнього показника максимальної концентрації вальпроату на 35 % (від 86 до 115 мкг/мл) порівняно з вальпроатом у режимі монотерапії. Збільшення дози фелбамату до 2400 мг/добу збшьшило середній показник максимальної концентрації вальпроату до 133 мкг/мл (щє на 16 %). Може виникнути потреба у зниженні дози вальпроату за умови початку прийому фелбамату.
Рифампін
У результаті дослідження, що включало застосування одноразової дози вальпроату (7 мг/кг) через 36 годин після 5 діб добового дозування рифампіну (600 мг), було виявлено збільшення кліренсу при пероральному прийомі вальпроату на 40 %. При одночасному застосуванні з рифампіном може виникнути потреба у корекції дози вальпроату.
Лікарські засоби, з якими або немає взаємодії’, або імовірна клінічно неважлива взаємодія
Антациди
У результаті дослідження, що передбачало одночасне застосування 500 мг вальпроату з широко використовуваними антацидами (Маалокс, Тризогель та Титралак — 160 міліграмеквівалент дози), не було виявлено ніякого впливу на ступінь поглинання вальпроату.
Хлорпромазин
У результаті дослідження, що включало застосування 100—300 мг/добу хлорпромазину пацієнтам із шизофренією, які вже отримували вальпроат (200 мг двічі на добу), було виявлено збільшення на 15 % рівня вальпроату у плазмі крові.
Галоперидол
У результаті дослідження, що включало застосування 6-10 мг/добу галоперидолу пацієнтам із шизофренією, які вже отримували вальпроат (200 мг двічі на добу), не було продемонстровано жодних значущих змін у загальних рівнях вальпроату у плазмі крові.
Циметидин та ранітидин
Циметидин та ранітидин не впливають на кліренс вальпроату.
Вплив вальпроату на інші лікарські засоби
Виявлено, що вальпроат є слабким інгібітором деяких ізоферментів цитохрому Р450, епоксидної гідрази та глюкуронозилтрансферази.
Нижче зазначена інформація про потенційний вплив одночасного застосування вальпроату на фармакокінетику або фармакодинаміку декількох широко застосовуваних лікарських засобів. Цей список не є вичерпним, оскільки постійно з’являються повідомлення про нові взаємодії. Препарати, стосовно яких спостерігається потенційно важлива взаємодія
Амітриптилін/Нортриптилін
У результаті прийому однієї дози амітриптиліну 50 мг перорально при застосуванні вальпроату (500 мг двічі на добу) встановлено зниження на 21 % кліренсу амітриптиліну у плазмі крові та зменшення сумарного кліренсу нортриптиліну на 34 %. Отримано рідкісні постмаркєтингові повідомлення про одночасне застосування вальпроату та амітриптиліну, що призводило до підвищення рівня амітрипталіну. Одночасне застосування вальпроату та амітриптиліну рідко було пов’язано з токсичним впливом. При одночасному прийомі вальпроату з амітриптиліном слід проводити моніторинг рівня амітриптиліну. Також потрібно враховувати зниження дози амітриптиліну/нортриптиліну при застосуванні вальпроату.
Карбамазепін/карбамазепін-10,11-епоксид
Рівні карбамазєпіну у сироватці крові знижувалися на 17%, а карбамазєпіну-10,11-епоксиду збільшувалися на 45 % при одночасному застосуванні вальпроату та карбамазєпіну пацієнтам з епілепсію.
Клоназепам
Одночасне застосування вальпроату та клоназепаму може спричинити абсанс-статус у пацієнтів із нападами абсансного типу в анамнезі.
Діазепам
Вальпроат витісняє діазепам з його ділянок зв’язування в альбуміні плазми крові та пригнічує його метаболізм. Одночасне застосування вальпроату (1500 мг на добу) здоровим добровольцям збільшувало вільну фракцію діазепаму (10 мг) на 90 %. У разі наявності вальпроату кліренс плазми та об’єм розподілу вільного діазепаму знижувався на 25 % і 20 % відповідно. Період напіввиведення діазепаму залишався незмінним після додавання вальпроату.
Етосуксимід
Вальпроат пригнічує метаболізм етосуксиміду. Застосування одноразової дози препарату етосуксимід у дозі 500 мг з вальпроатом (від 800 до 1600 мг на добу) здоровим добровольцям супроводжувалося збільшенням періоду напіврозпаду етосуксиміду на 25 % та зменшенням його загального кліренсу на 15 % порівняно з етосуксимідом у режимі монотерапії. У випадку пацієнтів, які отримують вальпроат та етосуксимід, особливо разом з іншими антиконвульсантами, слід стежити за змінами концентрації обох препаратів у сироватці крові.
Ламотриджин
У ході дослідження стаціонарного типу з участю здорових добровольців період напіввиведення ламотриджину збільшувався з 26 до 70 годин при одночасному застосуванні вальпроату (збільшення на 165 %). У разі одночасного застосування вальпроату дозу ламотриджину слід зменшувати. Повідомляли про серйозні шкірні реакції (такі як синдром Стівенса-Джонсона та токсичний епідермальний некроліз) при одночасному застосуванні ламотриджину та вальпроату. Докладно про дозу ламотриджину при одночасному застосуванні вальпроату дивись в Інструкції з медичного застосування ламотриджину.
Фенобарбітал
Встановлено, що вальпроат пригнічує метаболізм фенобарбіталу. Одночасне застосування вальпроату (250 мг двічі на добу протягом 14 днів) з фенобарбіталом здоровим добровольцям призводило до збільшення періоду напіввиведення на 50 % та зниження кліренсу фенобарбіталу у плазмі крові на ЗО % (одноразовий прийом 60 мг). Фракція дози фенобарбіталу, що виділялась у незміненому вигляді, збільшувалася на 50 % при застосуванні вальпроату.
Наявні дані про серйозне пригнічення ЦНС з або без значного підвищення плазмових концентрацій барбітурату або вальпроату. Слід ретельно стежити за проявами неврологічної токсичності у всіх пацієнтів, які одночасно отримують терапію барбітуратом. У разі можливості слід визначити плазмову концентрацію барбітурату та у разі необхідності — зменшити дозу барбітурату.
Примідон, що метаболізується до барбітурату, може мати подібну взаємодію з вальпроатом.
Фенітоїн
Вальпроат витісняє фенітоїн з його ділянок зв’язування в альбуміні плазми крові та пригнічує його метаболізм. Одночасний прийом вальпроату (400 мг тричі на добу) з фенітоїном (250 мг) здоровими добровольцями був асоційований зі збільшенням вільної фракції фенітоїну на 60 %. Загальний плазмовий кліренс та очевидний об’єм розподілу фенітоїну збільшувався на 30 % у разі наявності вальпроату. Кліренс та прогнозований об’єм розподілу вільного фенітоіну зменшувався на 25 %.
У пацієнтів з епілепсією були повідомлення про епілептичні напади, що виникали при поєднанні вальпроату та фенітоїну. Дозування фенітоїну слід регулювати відповідно до клінічної ситуації.
Пропофол
Одночасне застосування вальпроату та пропофолу може призвести до збільшення рівня пропофолу у крові. При одночасному застосуванні вальпроату слід зменшити дозу пропофолу. Забезпечити ретельний моніторинг пацієнтів на випадок прояву ознак підвищеної седативної дії або кардіореспіраторної недостатності.
Руфінамід
За результатами популяційного фармакокінетичного аналізу, вальпроат зменшував кліренс руфінаміду. Концентрації руфінаміду збільшувалися на <16 % - 70 % залежно від концентрації вальпроату (з більш високим зростанням у дітей, які отримували лікування високими дозами вальпроату або з підвищеними концентраціями вальпроату у плазмі крові). Перед призначенням вальпроату пацієнтам, у яких попередньо досягнуто стабільного стану на тлі прийому руфінаміду, слід розпочинати лікування вальпроатом низькими дозами і титрувати до клінічно ефективної дози. Подібним чином слід починати лікування у пацієнтів, що приймають вальпроат, з дози руфінаміду нижче 10 мг/кг на добу (діти) або 400 мг на добу (дорослі).
Толбутамід
За результатами експериментів in vitro, незв’язана фракція толбутаміду була збільшена з 20 % до 50 % при додаванні до зразків плазми крові, взятих у пацієнтів, які отримували лікування вальпроатом. Клінічна релевантність даного заміщення невідома..
Варфарин
У дослідженні in vitro вальпроат збільшував незв’язану фракцію варфарину до 32,6 %. Терапевтична релевантність даного явища невідома; однак слід проводити моніторинг тестів згортання крові у разі призначення терапії вальпроатом у пацієнтів, які приймають антикоагулянти.
Зидовудин
У шести пацієнтів з серопозитивною ВІЛ-інфекцією, після прийому вальпроату (250 або 500 мг кожні 24 години) кліренс зидовудину (100 мг кожні 24 години) знижувався на 38 %; період напіввиведення зидовудину не змінювався.
Лікарські засоби, з якими або немає взаємодії, або імовірна клінічно неважлива взаємодія
Ацетамінофен
Вальпроат не впливав на будь-які фармакокінетичні параметри ацетамінофену при одночасному призначенні пацієнтам на епілепсію.
Клозапін
При одночасному застосуванні вальпроату з клозапіном у психотичних пацієнтів взаємодію не встановлено.
Літій
Одночасне призначення вальпроату (500 мг двічі на добу) та літію карбонату (300 мг тричі на добу) здоровим добровольцям чоловічої статі не впливало на стаціонарну кінетику літію.
Лоразепам
Одночасне застосування вальпроату (500 мг двічі на добу) та лоразепаму (1 мг двічі на добу) здоровим добровольцям чоловічої статі супроводжувалося зменшенням плазмового кліренсу лоразепаму на 17 %.
Оланзапін
При одночасному застосуванні оланзапіну з вальпроатом немає необхідності у коригуванні дози оланзапіну. Одночасне призначення вальпроату (500 мг двічі на добу) та оланзапіну (5 мг) здоровим добровольцям призводило ДО 15 % зниження Стах і 35 % зниження площі під фармакокінетичною кривою (AUC) оланзапіну.
Пероральні стероїдні контрацептиви
У результаті одноразового прийому етинілестрадіолу (50 мкг)/левоноргестрелу (250 мкг) шістьом жінкам, які отримували лікування вальпроатом (200 мг двічі на добу) протягом 2 місяців не виявлено жодної фармакокінетичної взаємодії.
Топірамат
Одночасне застосування вальпроату і топірамату було асоційовано з гіперамоніємією з і без енцефалопатії. Одночасне призначення топірамату та вальпроату також було пов’язано з гіпотермією у пацієнтів, які отримували будь-який з цих лікарських засобів у режимі монотерапії. Доцільно перевіряти рівні амонію в крові пацієнтів, у яких повідомляли про початок гіпотермії.
Особливості застосування
Гепатотоксичність
Загальна інформація щодо гепатотоксичності
Печінкова недостатність, що виникає у пацієнтів, які отримують лікування вальпроатом, може призводити до летальних наслідків. Такі випадки зазвичай траплялися протягом перших 6 місяців лікування. Серйозній або летальній гепатотоксичності можуть передувати такі неспецифічні симптоми як нездужання, слабкість, летаргія, набряк обличчя, анорексія та блювання. У пацієнтів, хворих на епілепсію, також може спостерігатися втрата контролю над нападами. Слід забезпечувати ретельний нагляд за пацієнтами щодо виникнення таких симптомів. Печінкові проби (плазма) слід проводити перед початком терапії та через декілька інтервалів пізніше, особливо протягом перших 6 місяців лікування. Проте медичні працівники не повинні повною мірою спиратися на біохімічні показники плазми крові, оскільки ці тести можуть мати відхилення від норми в усіх випадках. Також слід враховувати результати ретельно зібраного проміжного анамнезу та фізичного обстеження.
Слід дотримуватись обережності при застосуванні препаратів вальпроату пацієнтам із хворобами печінки в анамнезі. Пацієнти, які приймають декілька антиконвульсантів, діти, ті, хто страждає від тяжких судомних нападів, що супроводжуються розумовою відсталістю та ті, хто страждає органічною хворобою головного мозку, належать до групи ризику.
Досвід показує, що у дітей віком до 2 років значно підвищений ризик розвитку гепатотоксичності, яка може призводити до летальних наслідків, особливо у тих, хто мають вищезгадані стани. Коли дівалпроекс натрію, таблетки пролонгованої дії призначати такій групі пацієнтів, його слід застосовувати з максимальною обережністю та в режимі монотерапії. Слід зважувати переваги терапії стосовно ризиків. Практика застосування у послідовно старших вікових групах пацієнтів з епілепсією свідчить про те, що частота летальної гепатотоксичності з віком значно зменшується.
Пацієнти з відомим або потенційним мітохондріальним захворюванням
Дівалпроекс натрію, таблетки пролонгованої дії протипоказаний пацієнтам з відомими мітохондріальними порушеннями, що спричинені мутаціями POLG, та дітям віком до 2 років, у яких підозрюють мітохондріальні розлади. Гостру печінкову недостатність та пов’язану з порушенням роботи печінки летальність, що індуковані вальпроатом, було зареєстровано у пацієнтів зі спадковими нейрометаболічними синдромами, спричиненими мутаціями у мітохондріальній ДНК-гамма-полімерази (POLG, наприклад, синдром Альперса-Хуттенлохера) з більшою частотою прояву порівняно з пацієнтами без таких синдромів. Більшість зареєстрованих випадків печінкової недостатності у пацієнтів з цими синдромами виявлено у дітей та підлітків.
Слід припускати наявність розладів, пов’язаних з POLG, у пацієнтів з подібними захворюваннями в сімейному анамнезі або ознаками розладів, подібних до пов’язаних з POLG, що включають, але не обмежені енцефалопатією нез’ясованої етіології, рефрактерною епілепсією (фокальною, міоклонічною), проявами епілептичного статусу, затримкою розвитку, психомоторною деградацією, аксонною сенсомоторною нейропатією, міопатичною мозочковою атаксією, офтальмоплегією або ускладненою мігренню з потиличною аурою. Діагностику мутацій POLG слід проводити згідно чинних клінічних рекомендацій з діагностичної оцінки таких розладів. Мутації А467Т та W748S виявляються приблизно у 2/з пацієнтів з аутосомно-рецесивними розладами, пов’язаними з POLG.
У пацієнтів віком від 2 років, у яких підозрюють спадкове мітохондріальне захворювання, дівалпроекс натрію, таблетки пролонгованої дії слід застосовувати лише тоді, коли інші антиконвульсанта виявилися неефективними. Під час застосування дівалпроекс натрію, таблетки пролонгованої дії у групі пацієнтів більш старшого віку слід забезпечувати пильне спостереження щодо розвитку гострого пошкодження печінки шляхом регулярного клінічного обстеження та моніторингу печінкових проб плазми крові.
Слід негайно припинити прийом лікарського засобу при підозрюваній або очевидній дисфункції печінки. У деяких випадках спостерігалося прогресування дисфункції печінки, незважаючи на припинення прийому препарату.
Вроджені вади розвитку
Вальпроати можуть спричиняти шкідливий вплив на плід при застосуванні вагітною жінкою.. Дані реєстру вагітних показують, що прийом вальпроату матір’ю може спричинити дефекти нервової трубки та інші структурні патології (наприклад, черепно-лицьові дефекти, аномалії серцево-судинної системи, гіпоспадії, деформації кінцівок). Частота вроджених вад розвитку у дітей, народжених матерями, які приймали вальпроати, приблизно в 4 рази перевищує частоту серед дітей, народжених жінками з епілепсією, які отримували інші протисудомні препарати у режимі монотерапії. Докази дозволяють припустити, що прийом фолієвої кислоти до зачаття та протягом 1 триместру вагітності знижує ризик розвитку вроджених дефектів нервової трубки у загальній популяції.
Зниження рівня IQ після внутріилньоутробного впливу
Вальпроати можуть спричиняти зниження показників IQ (коефіцієнт інтелекту), як наслідок впливу на внутрішньоутробний розвиток. Опубліковані епідеміологічні дослідження показали, що діти, які зазнали впливу вальпроату у внутрішньоутробному стані, мають нижчі когнітивні показники, ніж діти, які піддавалися внутрішньоутробному впливу інших протиепілептичних лікарських засобів або не зазнали жодного впливу протиепілептичних препаратів. Відповідно до даних досліджень було встановлено, що діти, які зазнали впливу від терапії вальпроатом у пренатальному періоді, мають нижчі показники IQ у віці 6 років порівняно з дітьми, які зазнали впливу від терапії іншими протиепілептичними лікарськими засобами у режимі монотерапії‘: ламотриджин, карбамазепін та фснітоїн. Невідомо, коли у період вагітності настають когнітивні ефекти у дітей під дією вальгіроату. Оскільки жінки в даному дослідженні отримували протиепілептичні лікарські засоби під час вагітності, не можна було оцінити, чи пов’язаний ризик зниження рівня інтелекту з певним періодом часу у період вагітності.
Хоча всі наявні дослідження мають методологічні обмеження, вагомість доказів підтверджує висновок про те, що внутрішньоутробна дія вальпроату може призвести до зниження рівня інтелекту у дітей.
Вальпроат протипоказаний у період вагітності жінкам, які приймають лікарський засіб з метою профілактики мігренозного головного болю. Жінкам з епілепсією або біполярним розладом, які вже вагітні або планують вагітність, не слід приймати вальпроат, за умови якщо інше лікування не дозволяє досягти адекватного контролю над симптомами або є неприйнятним з інших причин. У таких жінок переваги лікування вальпроатом у період вагітності можуть переважати ризики.
Застосування жінкам репродуктивного віку
У зв’язку з ризиком зниження рівня інтелекту та основних вроджених вад розвитку плода (в т.ч. дефектів нервової трубки), які можуть виникнути на самому початку вагітності, не можна призначати вальпроат жінкам репродуктивного віку, за винятком випадків, коли такий лікарський засіб є важливим для контролю стану їх здоров’я. Це особливо важливо, якщо розглядати призначення вальпроату при стані, який зазвичай не пов’язаний із постійною травматизацією чи загрозою летального наслідку (наприклад, мігрень). Під час застосування вальпроату жінки мають використовувати ефективні засоби контрацепції.
Жінкам репродуктивного віку необхідні регулярні консультації щодо відносних ризиків і переваг застосування вальпроату у період вагітності. Це особливо важливо для жінок, які планують вагітність, і для дівчат на початку статевого дозрівання. Слід розглянути альтернативні варіанти лікування для таких пацієнток.
Для запобігання серйозним нападам не треба раптово припиняти прийом вальпроату, оскільки це може спровокувати епілептичний статус, що призведе до гіпоксії організму матері та плода і загрози життю.
Наявні дані дозволяють припустити, що прийом фолієвої кислоти до зачаття та протягом І триместру вагітності знижує ризик розвитку вроджених дефектів нервової трубки у загальній популяції. Невідомо, чи зменшується ризик дефектів нервової трубки або зниження рівня інтелекту у немовлят, народжених жінками, які отримують вальпроат, за умови прийому фолієвої кислоти. Пацієнтам, які приймають вальпроат, слід рекомендувати приймати дієтичні добавки фолієвої кислоти як до зачаття, так і у період вагітності.
Панкреатит
Виявлено випадки небезпечного для життя панкреатиту як у дітей, так і у дорослих, які приймають вальпроат. Деякі випадки були описані як геморагічні зі швидким прогресуванням від початкових симптомів до настання летального наслідку. Деякі випадки виникали одразу після початку прийому препарату, а деякі після кількох років застосування. Частота на основі повідомлених випадків перевищує очікувану у загальній популяції. Повідомляли про випадки рецидиву панкреатиту після повторного призначення вальпроату. Слід попереджати пацієнтів та тих, хто за ними догліядає. що біль у животі, нудота, блювання та/або анорексія можуть бути симптомами панкреатиту, які вимагают ь швидкої медичної оцінки. Якщо встановлено діагноз «панкреатит», прийом дівалпроекс натрію, таблетки пролонгованої дії як правило припиняють у встановленому порядку. Альтернативне лікування основної медичної патології потрібно почати відповідно до клінічних показань.
Порушення циклу утворення сечовини Дівалпроекс натрію, таблетки пролонгованої дії протипоказаний пацієнтам з відомими розладами циклу утворення сечовини (орнітиновий цикл). Повідомляли про гіперамоніємічну енцефалопатію, іноді з летальним наслідком, зареєстровану після початку терапії вальпроатом у пацієнтів з порушеннями циклу сечовини, групу незвичайних генетичних аномалій, особливо дефіцит орнітин-транскарбамілази. Перед початком лікування дівалпроекс натрієм, таблетки, пролонгованої дії слід розглянути оцінку орнітинового циклу в наступних випадках:
1) пацієнти з енцефалопатією невстаповленого генезу або комою в анамнезі, енцефалопатією, пов’язаною з вмістом білка, енцефалопатією, пов’язаною з вагітністю або післяпологовою енцефалопатією, розумовою відсталістю невстаповленого ґенезу, з анамнезом підвищеного вмісту амонію або глютаміну у плазмі крові;
2) пацієнти з циклічним блюванням та летаргією, епізодичною сильною дратівливістю, атаксією, низьким вмістом азоту сечовини у плазмі крові або з непереносимістю білків;
3) пацієнти з сімейним анамнезом розладів циклу утворення сечовини або сімейним анамнезом нез’ясованої дитячої летальності (особливо у представників чоловічої статі);
4) пацієнти з іншими ознаками або симптомами порушення орнітинового циклу. Пацієнтам, у яких розвиваються симптоми гіперамоніємічних енцефалопатій невстановленого ґенезу під час терапії вальпроатом, слід забезпечити негайне лікування (у тому числі припинення прийому вальпроату) та перевірити наявність основних розладів циклу сечовини.
Суїцидальна поведінка та думки
Протиепілептичні лікарські засоби, в тому числі дівалпроекс натрію, таблетки пролонгованої дії, збільшують ризик виникнення суїцидальних думок або поведінки у пацієнтів, які приймають такі лікарські засоби з приводу будь-яких показань. Стан пацієнтів, які отримують лікування будь-яким протиепілептичним лікарським засобом з приводу будь-якого показання, має бути під контролем щодо появи або прогресування депресії, суїцидальних думок або поведінки та/або будь-яких незвичних змін настрою чи поведінки.
Підвищений ризик виникнення суїцидальних думок або поведінки при прийомі протиепілептичного лікарського засобу спостерігали ще через один тиждень після початку застосування протиепілептичних препаратів, який зберігався протягом тривалості досліджуваного лікування. Оскільки тривалість більшості досліджень, включених до аналізу, не перевищувала 24 тижні, не можливо оцінити ризик виникнення суїцидальних думок або поведінки за межами 24 тижнів.
Відносний ризик суїцидальних думок або поведінки був більшим у клінічних випробуваннях при епілепсії, ніж у клінічних дослідженнях при психіатричних та інших станах, але абсолютні відмінності ризику були подібними при епілепсії та психіатричних показаннях.
При розгляді призначення дівалпроекс натрію, таблетки пролонгованої дії або будь-якого іншого протиепілептичного лікарського засобу слід зважувати ризик виникнення суїцидальних думок та поведінки з ризиком хвороби без лікування. Епілепсія та багато інших захворювань, при яких призначають протиепілептичні лікарські засоби, самі по собі пов’язані із захворюваністю та летальністю, а також підвищеним ризиком виникнення суїцидальних думок і поведінки. У разі виникнення суїцидальних думок та поведінки під час терапії лікареві слід враховувати, чи може виникнення цих симптомів у будь-якого конкретного пацієнта бути пов’язаним із хворобою, що лікується.
Пацієнти, доглядаючий персонал та сім’ї повинні бути проінформовані про те, що протиепілептичні лікарські засоби збільшують ризик виникнення суїцидальних думок та поведінки. Вони мають бути повідомлені про необхідність бути готовими до виникнення або погіршення ознак та симптомів депресії, будь-яких незвичних змін настрою або поведінки чи виникнення суїцидальних думок, поведінки або думок про нанесення собі травми. Слід негайно повідомляти медичних працівників про підозрілу поведінку.
Кровотечі та інші гемопоетичні розлади
Вальпроат пов’язаний з дозозалежною тромбоцитопенією. У клінічному дослідженні вальпроату у режимі монотерапії при епілепсії у пацієнтів, які отримували дозування в середньому приблизно 50 мг/кг/добу, принаймні один показник тромбоцитів становив ≤75х10 9/л. Приблизно половина цих пацієнтів припинили лікування, при цьому рівень тромбоцитів повернувся до норми. У решти пацієнтів кількість тромбоцитів нормалізувалася у процесі продовженого лікування. У даному дослідженні імовірність тромбоцитопенії суттєво зросла при загальній концентрації вальпроату ≥110 мкг/мл (жінки) або ≥135 мкг/мл (чоловіки). Терапевтичну перевагу, що може супроводжувати більш високі дози слід зважувати з імовірністю виникнення більшої кількості побічних реакцій. Застосування вальпроату також пов’язано зі зменшенням інших клітинних ліній та мієлодисплазією.
Зважаючи на повідомлення про цитопенію, інгібування вторинної фази агрегації тромбоцитів та аномальні показники коагуляції (наприклад, низький рівень фібриногену, порушення коефіцієнта коагуляції, набута хвороба фон Віллебранда), перед початком терапії рекомендують проводити повний аналіз крові та періодично перевіряти показники коагуляції. Пацієнтам, які отримують дівалпроекс натрію, таблетки пролонгованої дії, рекомендовано проведення обов’язкового контролю показників крові та коагуляційних тестів перед плановим хірургічним втручанням та у період вагітності. Наявність кровотечі, гематом або порушення гемостазу/коагуляції є показанням до зниження дози або відміни терапії.
Гіперамоніємія
Повідомляли про гіперамоніємію, пов’язану з терапією вальпроатом; вона може існувати, незалежно від нормальних функціональних печінкових проб. У випадку пацієнтів з проявами сонливості та блювання невстановленої етіології або змінами психічного стану слід розглянути гіперамоніємічну енцефалопатію та визначити рівень амонію. Гіперамоніємію також слід розглядати у пацієнтів з гіпотермією. При підвищенні рівня амонію застосування в.альпроату слід припинити. Необхідно вжити відповідних заходів для лікування гіперамоніємії. Такі пацієнти мають пройти обстеження щодо основних розладів циклу сечовини.
Безсимптомні підвищення амонію є більш поширеними і у разі наявності потребують ретельного моніторингу рівня амонію у плазмі крові. Якщо підвищення зберігається, слід розглянути припинення прийому вальпроату.
Гіперамоніємія та енцефалонатія, пов’язані з одночасним застосуванням топірамату
Одночасне застосування топірамату та вальпроату пов’язано з гіперамоніємією з або без енцефалопатії у пацієнтів, які отримували будь-який із цих лікарських засобів у режимі монотерапії. Клінічні симптоми гіперамоніємічної енцефалопатії часто включають різкі зміни рівня свідомості та/або когнітивної функції з летаргією або блюванням. Гіпотермія також може бути проявом гіперамоніємії. У більшості випадків симптоми та ознаки зменшуються при відміні будь-якого препарату. Така побічна реакція не пов’язана з фармакокінетичною взаємодією. Пацієнти з вродженими порушеннями метаболізму або зниженням активності мітохондрій печінки можуть мати підвищений ризик виникнення гіперамоніємії з або без енцефалопатії. Хоча це не досліджено, взаємодія топірамату з вальпроатом може загострювати наявні порушення або «демаскувати» розлад в осіб зі схильністю до таких порушень. У випадку пацієнтів із летаргією та блюванням невстановленої етіології або змінами психічного стану доцільно розглянути гіперамоніємічну енцефалопатію та визначити рівень амонію.
Гіпотермія
Повідомляли про гіпотермію, яка визначається як небажане зниження температури тіла до <35 °С (95 °F), у зв’язку з терапією вальпроатом як у поєднанні з гіперамоніємією, так і у разі її відсутності. Така побічна реакція також може спостерігатися у пацієнтів при одночасному прийомі топірамату з вальпроатом після початку лікування топіраматом або після збільшення добової дози топірамату. Слід розглянути припинення прийому вальпроату у разі наявності гіпотермії, що може проявлятися у вигляді різних клінічних порушень, у тому числі млявості, сплутаності свідомості, коми та значних змін в інших основних системах органів, таких як серцево-судинна та дихальна системи. Клінічне ведення та оцінка мають включати визначення рівня амонію в крові.
Реакція на лікарський засіб з еозинофілією та системними проявами (DRESS/Поліорганні реакції гіперчутливості
Реакцію на лікарський засіб з еозинофілією та системними проявами (DRESS), також відому як поліорганна гіперчутливість, зареєстровано у пацієнтів, які приймали вальпроат. DRESS може мати летальний наслідок або становити небезпеку для життя. DRESS, як правило, хоча не обов’язково, проявляється у вигляді пропасниці, висипу та/або лімфаденопатії у поєднанні з ураженням іншої системи органів, наприклад з гепатитом, нефритом, гематологічними відхиленнями, міокардитом або міозитом, який іноді нагадує гостру вірусну інфекцію. Часто виявляється еозинофілія. Оскільки цей розлад має різні прояви, можуть бути уражені інші системи органів, що не вказані у даному розділі. Важливо зазначити, що ранні прояви підвищеної‘ чутливості, такі як пропасниця або лімфаденопатія, можуть мати місце навіть у разі відсутності висипу. Слід негайно провести огляд хворого при наявності таких ознак або симптомів. Прийом вальпроату слід припинити, а у разі неможливості визначення альтернативної етіології ознак або симптомів не відновлювати його прийом.
Взаємодія з карбапснемовими антибіотиками
Карбапенемові антибіотики (наприклад, ертапенем, іміпенем, меропенем; список не повний) можуть знижувати концентрацію вальпроату у сироватці крові до субтерапевтичних рівнів, що призведе до втрати контролю над нападами. Слід часто перевіряти концентрацію вальпроату у сироватці крові після початку лікування карбапенемом. У разі суттєвого зниження концентрації вальпроату у плазмі крові або погіршенні контролю над нападами слід розглянути альтернативну антибактеріальну або протисудомну терапію.
Сонливість у пацієнтів літнього віку
У подвійному сліпому багатоцентровому випробуванні вальпроату у пацієнтів літнього віку з деменцією (середній вік = 83 роки), дозу було збільшено на 125 мг/добу до цільової дози 20 мг/кг/добу. Значно більша частка пацієнтів, які приймали вальпроат, мала сонливість порівняно з плацебо, і, хоча це не було статистично значущим, також спостерігали більшу частку пацієнтів із дегідратацією. Припинення прийому лікарського засобу внаслідок сонливості також були значно вищими, ніж у групі плацебо. У деяких пацієнтів із сонливістю (приблизно половина) спостерігалося зниження споживання їжі та зменшення маси тіла. У пацієнтів, які мали вищевказані ознаки, встановлено тенденцію до більш низької початкової концентрації альбуміну, зниження кліренсу вальпроату і більш високого вмісту азоту сечовини у плазмі крові. У пацієнтів літнього віку дозування слід збільшувати повільніше і регулярно контролювати споживання рідини та їжі, зневоднення, сонливість та інші побічні реакції. У пацієнтів зі зниженням споживання їжі або рідини та у випадку надмірної сонливості слід розглянути зниження дози або припинення застосування вальпроату.
Моніторинг концентрації лікарського засобу в плазмі крові
Оскільки вальпроат може взаємодіяти з одночасно призначеними лікарськими засобами, здатними до індукції ферментів, рекомендовано проводити періодичні визначення концентрації вальпроату і супутніх лікарських засобів у плазмі крові протягом раннього періоду терапії.
Вплив на вміст кетону та дослідження функції щитовидної залози
Вальпроат частково виводиться з сечею у вигляді кето-метаболіту, що може призвести до хибної інтерпретації тесту на вміст кетону в сечі.
Повідомляли про зміни результатів дослідження функції щитовидної залози внаслідок прийому вальпроату. Клінічне значення цього факту невідоме.
Вплив на реплікацію BІЛ та ЦМВ
Згідно з деякими дослідженнями in vitro,вальпроат може стимулювати реплікацію ВІЛ та ЦМВ за певних експериментальних умов. Клінічні наслідки невідомі. Крім того, релевантність даних висновків in vitroє невизначеною для пацієнтів, які отримують максимально супресивну антиретровірусну терапію. Проте ці дані слід брати до уваги при інтерпретації результатів регулярного моніторингу вірусного навантаження у ВІЛ-позитивних пацієнтів, які приймають вальпроат, або під час клінічного нагляду за пацієнтами із ЦМВ.
Залишки лікарського засобу у калових масах
Рідко повідомляли про залишки лікарського засобу в калі. У деяких пацієнтів були анатомічні (у т.ч. ілеостомія або колостомія) або функціональні захворювання шлунково-кишкового тракту зі скороченими інтервалами шлунково-кишкового транзиту. У деяких звітах питання залишків лікарського засобу мало місце у контексті діареї. Рекомендується перевіряти рівні вальпроату у плазмі крові пацієнтів, у яких виявлено залишки лікарського засобу у калових масах, та стежити за клінічним станом пацієнтів. У разі наявності клінічних показань можна розглянути альтернативне лікування.
Пацієнти з недостатністю лактази, галактоземією або синдромом порушення всмоктування глюкози/галактози
Даний лікарський засіб містить у своєму складі лактозу. Не приймати пацієнтам із недостатністю лактази, галактоземією або синдромом порушення всмоктування глюкози/галактози.
Застосування дівалпроекс натрію у дітей вивчали у багатьох клінічних дослідженнях. У двох подвійних сліпих плацебо-контрольованих дослідженнях з оцінки ефективності дівалпроексу пролонгованої дії для показань «манія» та «мігрень» ефективності не встановлено ні при лікуванні мігрені, ні при лікуванні манії. Найбільш поширеними побічними реакціями, пов’язаними з лікарським засобом (повідомлено про >5 % і вдвічі більше у показника плацебо), зареєстрованими у контрольованому педіатричному дослідженні манії, були нудота, біль у верхній частині живота, сонливість, підвищення рівня амонію, гастрит та висип. Решта випробувань стосувалися довгострокових досліджень безпеки. У цих клінічних випробуваннях безпека та переносимість дівалпроекс натрію у дітей показали, що вони порівнянні з показниками у дорослих.
Пацієнти літнього віку
Жодного пацієнта віком понад 65 років не було залучено до участі у клінічних випробуваннях з маніакального синдрому, пов’язаного з біполярними розладами.
У наявних дослідженнях у пацієнтів літнього віку з деменцією виявлено сонливість, пов’язану із застосуванням лікарського засобу, частота виникнення якої була дещо вищою у пацієнтів з дегідратацією. Потреба у припиненні прийому лікарського засобу у зв’язку з сонливістю виникала частіше, ніж у групі плацебо. У таких пацієнтів потрібно зменшити початкову дозу, а у разі надмірної сонливості слід розглянути зменшення дози або припинення застосування лікарського засобу.
Існує недостатньо інформації для визначення безпеки та ефективності вальпроату для профілактики мігрені у пацієнтів віком понад 65 років.
Спроможність пацієнтів літнього віку (віковий діапазон: 68-89 років) щодо елімінації вальпроату знижується порівняно з дорослими пацієнтами молодшого віку (віковий діапазон: 22-26 років).
Застосування у період вагітності або годування груддю
У зв’язку з ризиком зниження рівня інтелекту, дефектів нервової трубки та інших основних вроджених вад розвитку плода, які можуть виникнути дуже рано у період вагітності, не слід призначати вальпроат жінкам репродуктивного віку, за винятком випадків, коли терапевтична користь від застосування препарату переважає ризики (за ступенем ризику для плода).
Вагітність категорія D щодо епілепсії та маніакальних епізодів, пов’язаних з біполярним розладом.
Вагітність категорія X щодо профілактики мігренеподібного головного болю.
Резюме про ризик для розвитку плода
Незалежно від впливу лікарського засобу початкова частота вроджених дефектів кожної вагітності становить близько 3 %, ризик переривання вагітності — близько 15 %, або ризик виникнення інших несприятливих наслідків. Застосування вальпроату жінкою протягом вагітності за будь-яким показанням підвищує ризик виникнення вроджених вад розвитку, зокрема дефектів нервової трубки, а також аномалій, що включають інші системи організму (наприклад, черепно-лицеві дефекти, серцево-судинні вади, гіпоспадію, аномалії кінцівок). Найбільший ризик розвитку основних структурних аномалій у І триместрі; однак інші серйозні дефекти розвитку можуть мати місце при використанні вальпроату протягом усього періоду вагітності. Частота вроджених вад розвитку у дітей, народжених матерями з епілепсією, які приймали вальпроат у період вагітності, приблизно в 4 рази перевищує частоту серед дітей, народжених жінками з епілепсією, які отримували інші протиепілептичні лікарські засоби у режимі монотерапії.
Наявні дані свідчать, що діти, які зазнали впливу вальпроату у внутрішньоутробному стані, мають нижчі когнітивні показники, ніж діти, які піддавалися внутрішньоутробному впливу як іншого протиепілептичног‘о лікарського засобу, так і у разі відсутності протиепілептичних лікарських засобів.
Обсерваційні дослідження показали, що вплив препаратів вальпроату у період вагітності може збільшувати ризик розладів аутистичного спектру. Відповідно до дослідження ризик для дітей, які народилися від матерів, які приймали препарати вальпроату у період вагітності, у 2,9 раза перевищував ризик (95 % довірчий інтервал [СІ]: 1,7-4,9) розвитку розладів аутистичного спектра порівняно з дітьми, народженими матерями, які не підхвалися впливу вальпроату у період вагітності. Абсолютний ризик розладів аутистичного спектра становив 4,4 % у дітей внаслідок впливу вальпроату та 1,5 % у дітей, які не піддавалися впливу вальпроату. Оскільки дослідження було обсерваційним за своїм дизайном, висновки про причинно-наслідковий зв’язок між внутрішньоутробним впливом вальпроату та підвищеним ризиком розладу аутистичного спектра не можна вважати остаточним.
Відповідно до наявних даних досліджень на тваринах встановлено, що у потомства з пренатальним впливом вальпроату вади розвитку подібні до тих самих показників з участю людей, та продемонстровано нейроповедінкові порушення.
Клінічні аспекти
• Дефекти нервової трубки — це вроджена аномалія, найтісніше пов’язана з прийомом вальпроату вагітною. Ризик spina bifida (незрощення дужок хребців) після внутрішньоутробного впливу вальпроату загалом оцінюється як 1—2 % порівняно з оцінкою загального популяційного ризику spina bifida, що становить приблизно 0,06-0,07 % (6-7 випадків на 10000 новонароджених).
• Вальпроат може призвести до зниження коефіцієнта інтелекту (IQ) у дітей, чиїм матерям призначали вальпроат у період вагітності.
• Через ризик зменшення коефіцієнта інтелекту (IQ), дефектів нервової трубки та інших побічних ефектів для плода, які можуть виникнути на ранніх термінах вагітності, рекомендовано наступне:
— Вальпроат не слід призначати жінці репродуктивного віку, якщо цей лікарський засіб не є необхідним для лікування стану її здоров’я. Це особливо важливо, якщо розглядати призначення вальпроату при стані, який зазвичай не пов’язаний із постійною травматизацією або ризиком летального наслідку (наприклад, мігрень);
— Вальпроат протипоказаний у період вагітності жінкам, які застосовують лікарський засіб для профілактики мігренеподібного головного болю;
— Вальпроат не слід застосовувати для лікування жінок з епілепсією або біполярним розладом, які вже вагітні або планують завагітніти, якщо інші методи лікування не забезпечили належного контролю над симптомами або були з інших причин неприйнятними. У таких жінок переваги лікування вальпроатом у період вагітності можуть все ще переважати ризики. При лікуванні вагітної або жінки репродуктивного віку потрібно уважно розглянути потенційні ризики, переваги лікування, а також забезпечити належне консультування.
• Для запобігання серйозним нападам жінкам з епілепсією не слід раптово припиняти прийом вальпроату, оскільки це може спровокувати виникнення епілептичного статусу, що спричинить гіпоксію організму матері та плода і загрозу життю. Навіть незначні судоми можуть становити небезпеку для ембріона або плода, що розвивається. Проте припинення прийому препарату., може розглядатися до і у період вагітності в окремих випадках, якщо тяжкість та частота виникнення захворювання не становить серйозної загрози для пацієнта.
• Вагітним жінкам, які приймають вальпроат, слід запропонувати наявну пренатальну діагностику для виявлення дефектів нервової трубки та інших вад розвитку.
• Доказові дані дозволяють припустити, що прийом фолієвої кислоти до зачаття та протягом І триместру вагітності знижує ризик розвитку вроджених дефектів нервової трубки у загальній популяції. Невідомо, чи зменшується ризик дефектів нервової трубки або зниження рівня інтелекту у немовлят, народжених жінками, які отримують вальпроат, за умови прийому фолієвої кислоти. Пацієнтам, які приймають вальпроат, потрібно постійно рекомендувати дієтичні добавки фолієвої кислоты як до зачаття, так і у період вагітності.
• У вагітних, які приймають вальпроат, можуть розвинутися порушення згортання крові, у т.ч. тромбоцитопенія, гіпофібриногенемія та/або зменшення інших коагуляційних факторів, що може призвести до геморагічних ускладнень у новонародженого, включаючи летальний наслідок. Якщо вальпроат застосовувати у період вагітності, слід ретельно контролювати параметри згортання крові у матері. У разі виявлення порушень зі згортанням в організмі матері такі параметри також слід контролювати у новонародженого.
• У пацієнтів, які приймають вальпроат, може розвинутися печінкова недостатність. Після застосування вальпроату у період вагітності також повідомляли про випадки печінкової
недостатності з летальним наслідком у новонароджених, які зазнали внутрішньоутробного впливу вальпроату.
• Повідомляли про гіпоглікемію у новонароджених, чиї матері приймали вальпроат у період вагітності.
Наявні дослідження показали, що діти, які зазнали впливу вальпроату у внутрішньоутробному періоді, мають нижчі когнітивні показники, ніж діти, які піддавалися внутрішньоутробному впливу як іншого протиепілептичного лікарського засобу, так і у разі відсутності протиепілептичного лікарського засобу. Оскільки жінки в наявних дослідженнях отримували протиепілептичні лікарські засоби у період вагітності, не можна було оцінити, чи ризик зниження рівня інтелекту пов’язаний з певним періодом часу у період вагітності.
Хоча всі наявні дослідження мають методологічні обмеження, вагомість доказів підтверджує взаємозв’язок внутрішньоутробної дії вальпроату з подальшими несприятливими наслідками для когнітивного розвитку.
Наявні дані про випадки летальної печінкової недостатності у дітей, чиї матері приймали вальпроат у період вагітності.
Період годування груддю
Вальпроат проникає у грудне молоко людини. Слід дотримуватись обережності при призначенні вальпроату жінці, яка годує груддю.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Лікарський засіб впливає на здатність керувати транспортними засобами або іншими механізмами у зв’язку з можливим розвитком побічних реакцій. Лікарський засіб може сповільнювати мислення та рухові навички.
Спосіб застосування Теравас та дози
Теравас є лікарським засобом з пролонгованим вивільненням, що призначається для перорального прийому 1 раз на добу. Таблетки слід ковтати цілими, не розламувати та не розжовувати.
Маніакальний синдром
Рекомендована початкова доза становить 25 мг/кг/доба 1 раз на добу. Слід збільшувати дозу якомога швидше для досягнення найнижчої терапевтичної дози, яка дає бажаний клінічний ефект або бажаний діапазон концентрації у плазмі крові. Максимальна рекомендована доза становить 60 мг/кг/добу.
Епілепсія
Оскільки дозування лікарського засобу титрується у сторону підвищення, це може мати вплив на концентрацію клоназепаму, діазепаму, етосуксиміду, ламотриджину, толбутаміду, фенобарбіталу, карбамазепіну та/або фенітоїну (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Складні парціальні напади
Для дорослих та дітей віком від 10 років.
Монотерапія (початкова терапія)
Систематичних досліджень дівалпроекс натрію, таблетки пролонгованої дії в якості початкової терапії не проводили. Пацієнтам слід розпочати лікування з 10 до 15 мг/кг/добу. Для досягнення оптимально клінічної відповіді дозу потрібно збільшувати на 5-10 мг/кг/тиждень. Як правило, оптимальна клінічна відповідь досягається при добових дозах нижче 60 мг/кг/добу. Якщо задовільна клінічна відповідь не досягнута, необхідно перевірити рівень концентрації препарату у плазмі крові для визначення того, чи знаходиться він у загальноприйнятому терапевтичному діапазоні (від 50 до 100 мкг/мл). Рекомендації щодо безпечності використання вальпроату у дозах, що перевищують 60 мг/кг/добу, відсутні. Імовірність тромбоцитопенії значно збільшується при загальній концентрації вальпроату у сироватці крові (визначається перед застосуванням першої добової дози) понад 110 мкг/мл у жінок та 135 мкг/мл у чоловіків. Перевагу посиленого контролю над нападами при більш високих дозах слід порівнювати з можливістю більшої кількості побічних реакцій.
Перехід на монотерапію
Пацієнти повинні починати лікування з 10 до 15 мг/кг/добу. Для досягнення оптимальної клінічної відповіді дозу потрібно збільшувати на 5-10 мг/кг/тиждень. Як правило, оптимальна клінічна відповідь досягається при добових дозах нижче 60 мг/кг/добу. Якщо задовільна клінічна відповідь не досягнута, необхідно перевірити рівень вальпроату у плазмі для визначення того, чи знаходиться він у загальноприйнятому терапевтичному діапазоні (від 50 до 100 мкг/мл). Рекомендації щодо безпечності використання вальпроату у дозах, що перевищують 60 мг/кг/добу, відсутні.
Доза супутнього протиепілептичного лікарського засобу може зазвичай зменшуватися приблизно на 25 % кожні 2 тижні. Таке зменшення можна розпочинати на початку застосування дівалпроекс натрію, таблетки пролонгованої дії або пізніше, через 1-2 тижні у разі підозри щодо виникнення нападів за умови зменшення дози. Швидкість і тривалість припинення прийому супутнього протиепілептичного лікарського засобу можуть бути дуже різними; під час цього періоду потрібно забезпечити ретельний нагляд за пацієнтами щодо збільшення частоти нападів.
Допоміжна терапія
Теравас можна додавати до схеми лікування пацієнта у дозі від 10 до 15 мг/кг/добу. Для досягнення оптимальної клінічної відповіді дозу потрібно збільшувати на 5-10 мг/кг/тиждень. Як правило, оптимальна клінічна відповідь досягається при добових дозах нижче 60 мг/кг/добу. Якщо задовільна клінічна відповідь не досягнута, необхідно перевірити рівень концентрації препарату у плазмі крові для визначення того, чи знаходиться він в загальноприйнятому терапевтичному діапазоні (від 50 до 100 мкг/мл). Рекомендації щодо безпечності використання вальпроату у дозах, що перевищують 60 мг/кг/добу, відсутні.
У дослідженні допоміжної терапії при складних парціальних нападах, у якому пацієнти отримували або карбамазепін, або фенітоїн додатково до вальпроату, жодної потреби у коригуванні дозування карбамазепіну або фенітоїну не було. Проте, оскільки вальпроат може взаємодіяти з цими або іншими протиепілептичними лікарськими засобами при одночасному застосуванні, а також з іншими лікарськими засобами, рекомендовано проводити періодичні визначення концентрації у плазмі крові супутніх протиепілептичних лікарських засобів протягом раннього курсу терапії.
Простий та складний абсанс
Рекомендована початкова доза становить 15 мг/кг/добу, яку з інтервалом в один тиждень слід збільшувати по 5-10 мг/кг/добу, поки не буде досягнуто контролю над нападами або побічні реакції не перешкоджатимуть подальшому збільшенню. Максимальна рекомендована доза становить 60 мг/кг/добу.
Повну кореляцію між добовою дозою, концентрацією у сироватці крові та терапевтичним ч. у ефектом не встановлено. Однак для більшості пацієнтів з абсансами терапевтичною вважається концентрація вальпроату у плазмі крові від 50 до 100 мкг/мл. Стан деяких пацієнтів слід контролювати при нижчій або вищій концентрації у сироватці крові.
Оскільки доза дівалпроекс натрію, таблетки пролонгованої дії титрується у сторону підвищення, це може мати вплив на концентрацію фенобарбіталу та/або фенітоїну у крові.
Не можна раптово припиняти прийом протиепілептичних лікарських засобів пацієнтам, які приймають лікарський засіб з метою попередження серйозних нападів, внаслідок великої ймовірності провокуючого епілептичного статусу з супроводжуючою гіпоксією та загрозою для життя.
Мігрень
Теравас показаний для профілактики мігренозного головного болю.
Рекомендована початкова доза становить 500 мг 1 раз на добу протягом 1 тижня, після чого збільшується до 1000 мг 1 раз на добу. Незважаючи на відсутність оцінки іншого дозування дівалпроекс натрію, таблетки пролонгованої дії при мігренях окрім 1000 мг 1 раз на добу, діапазон ефективних доз дівалпроекс натрію, таблетки з модифікованим вивільненням у цих пацієнтів становить 500-1000 мг на добу. Як і у випадку з іншими препаратами вальпроату, вибір дози дівалпроекс натрію, таблетки пролонгованої дії має бути індивідуальним для кожного пацієнта. Може виникнути потреба у коригуванні дози. Якщо пацієнт потребує коригувань менших доз, ніж ті, що доступні у випадку з дівалпроекс натрієм, таблетки пролонгованої дії, замість цього потрібно застосовувати дівалпроекс натрію, таблетках з модифікованим вивільненням.
Перехід від дівалпроекс натрію, таблетки з модифікованим вивільненням до дівалпроекс натрію, таблетки пролонгованої дії
Дорослим та дітям віком >10 років з епілепсією, які раніше отримували дівалпроекс натрію, таблетки з модифікованим вивільненням, слід приймати дівалпроекс натрію, таблетки пролонгованої дії 1 раз на добу в дозі на 8-20 % вищій, ніж загальна добова доза дівалпроекс натрію, таблетки з модифікованим вивільненням (таблиця 1). Для пацієнтів, які отримують загальну добову дозу дівалпроекс натрію, таблетки з модифікованим вивільненням, яких не можна напряму перевести на дівалпроекс натрію, таблетки пролонгованої дії, може бути прийнято рішення збільшити загальну добову дозу лікарського засобу дівалпроекс натрію, таблетки з модифікованим вивільненням, яку отримує пацієнт, до наступної більшої дози, перш ніж перейти на відповідну загальну добову дозу дівалпроекс натрію, таблетки пролонгованої дії.
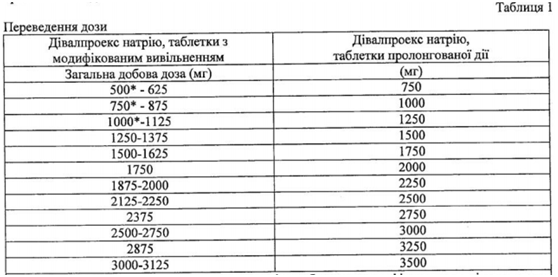
* Загальні дані добової дози дівалпроекс натрію, таблетки з модифікованим вивільненням не можна безпосередньо перевести на загальну добову дозу дівалпроекс натрію, таблетки пролонгованої дії, вищу на 8-20 %, оскільки необхідна концентрація дозування дівалпроекс натрію, таблетки пролонгованої дії відсутня. Може бути прийнято рішення збільшити загальну добову дозу дівалпроекс натрію, таблетки з модифікованим вивільненням, яку отримує пацієнт, до наступної більшої дози, перш ніж перейти на відповідну загальну добову цозу дівалпроекс натрію, таблетки пролонгованої дії.
Не існує достатньо даних для рекомендації коефіцієнта переходу для пацієнтів з дозами дівалпроекс натрію, таблетки з модифікованим вивільненням понад 3,125 мг/добу. Концентрація Cmin вальпроату у плазмі крові для дівалпроекс натрію, таблетки пролонгованої дії у середньому еквівалентна дівалпроекс натрію, таблетки з модифікованим вивільненням, але може змінюватися у пацієнтів після переведення. Якщо задовільної клінічної відповіді не досягнуто, слід перевірити рівні концентрації препарату у плазмі крові для визначення того, чи знаходяться вони у загальноприйнятому терапевтичному діапазоні (від 50 до 100 мкг/мл).
Загальні рекомендації дозування
Дозування для людей літнього віку
У результаті зменшення кліренсу незв’язаного вальпроату і, можливо, більшої чутливості до сонливості у людей літнього віку, початкову дозу для таких пацієнтів слід зменшити. Досягнення початкових доз нижче 250 мг у людей літнього віку можливе тільки за умови прийому дівалпроекс натрію, таблетки з модифікованим вивільненням. Дозування слід збільшувати повільніше і регулярно контролювати споживання рідини та їжі, зневоднення, сонливість та інші побічні реакції. У пацієнтів зі зниженим споживанням їжі або рідини та у випадку надмірної сонливості слід розглянути зниження дози або припинення застосування вальпроату.
Кінцева терапевтична доза має досягатися на основі як переносимості, так і клінічної відповіді.
Дозозалежні побічні реакції
Частота побічних ефектів (особливо підвищення рівнів ферментів печінки та тромбоцитопенія) може залежати від дози. Імовірність тромбоцитопенії суттєво зростає при загальній концентрації вальпроату ≥110 мкг/мл у жінок або ≥135 мкг/мл у чоловіків. Перевагу посиленого контролю над нападами при більш високих дозах слід порівнювати з можливістю виникнення більшої кількості побічних реакцій.
Подразнення шлунково-кишкового тракту
Пацієнтам із подразненням шлунково-кишкового тракту краще приймати лікарський засіб з їжею або повільно збільшувати дози з початкового низького рівня.
Дотримання режиму дозування
Пацієнти мають бути проінформовані про важливість прийому лікарського засобу Теравас щодня відповідно до призначення. Якщо пацієнт пропускає прийом дози лікарського засобу, її слід прийняти якомога швидше, навіть якщо майже настав час для наступної дози. Якщо пропускається прийом дози, пацієнт не повинен подвоювати наступну дозу.
Дозування для пацієнтів, які приймають руфінамід
Пацієнтам, у яких стабілізувався стан на тлі прийому руфінаміду перед призначенням вальпроату, слід розпочинати лікування вальпроатом при низькій дозі і титрувати до клінічно ефективної дози.
Діти
Можна застосовувати дітям віком від 10 років і старше у якості монотерапії та допоміжної терапії для лікування складник парціальних епілептичних нападів; у якості монотерапії та ад’ювантної терапії при лікуванні простих та складних малих епілептичних нападів (абсансів); у якості додаткової терапії при різних типах нападів, включаючи абсанси (див. розділ «Спосіб застосування та дози»).
Передозування
Передозування вальпроатом може призвести до сонливості, блокади серця, глибокої коми і гіпсрнатріємії’ Повідомляли про летальні наслідки; проте деякі пацієнти одужували з рівнями вальпроату до 2120 мкг/мл.
У випадках передозування фракція лікарського засобу, непов’язаного з білком, висока. Гемодіаліз або гемодіаліз у поєднанні з гемоперфузією може забезпечувати значне виведення лікарського засобу. Користь від промивання шлунка або блювання відрізняється залежно від часу після прийому препарату. Слід вжити загальних підтримувальних заходів з особливою увагою до підтримки адекватного виведення сечі.
Як повідомляли, налоксон забезпечує оборотний характер депресантів ЦНС при передозуванні вальпроату. Оскільки налоксон може теоретично також змінити протиепілептичні ефекти вальпроату, його слід застосовувати з обережністю у пацієнтів з епілепсією.
Побічні реакції
У даному розділі описані наступні серйозні побічні реакції:
— печінкова недостатність;
— вроджені вади розвитку;
— зниження рівня коефіцієнту інтелекту (IQ) внаслідок впливу у внутрішньоутробному періоді;
— панкреатит;
— гіперамоніємічна енцефалопатіл;
— суїцидальна поведінка та суїцидальне мислення;
— кровотечі та інші гемопоетичні розлади;
— гіпотермія;
— реакція на лікарський засіб з еозинофілією та системними проявами (DRESS)/Поліорганні реакції гіперчутливості;
— сонливість у пацієнтів літнього віку.
Оскільки клінічні дослідження проводять в дуже різноманітних умовах, частоту побічних реакцій, що спостерігаються у ході клінічних досліджень лікарського засобу, не можна напряму порівнювати з показниками частоти у клінічних дослідженнях іншого лікарського засобу, і це може не відображати частоту, що спостерігається на практиці.
Маніакальний синдром
Частота випадків, що виникають при лікуванні, була встановлена на підставі комбінованих наявних даних плацебо-контрольованих досліджень дівалпроекс натрію, таблетки пролонгованої дії при лікуванні маніакальних епізодів, пов’язаних з біполярним розладом. Побічні реакції у >5 % пацієнтів, які отримували дівалпроекс натрію, таблетки пролонгованої дії, під час досліджень гострого маніакального синдрому: сонливість, диспепсія, нудота, блювання, діарея, запаморочення, біль, абдомінальний біль, випадкова травма, астенія, фарингіт.
Наступні додаткові побічні реакції зареєстровано у більш ніж 1 % пацієнтів, які отримували дівалпроекс натрію, таблетки пролонгованої дії у ході контрольованих клінічних досліджень.
Загальні розлади: біль у спині, озноб, озноб з пропасницею, підвищення рівня лікарського засобу, грипоподібний синдром, інфекція, грибкова інфекція, ригідність м’язів шиї.
З боку серцево-судинної системи: аритмія, артеріальна гіпертензія, гіпотензія, ортостатична гіпотензія.
З боку системи травлення: запор,, сухість у роті, дисфагія, нетримання калових мас, метеоризм, гастроентерит, глосит, кровоточивість ясен, виразки ротової порожнини.
З боку системи крові та лімфатичної системи: анемія, збільшення часу кровотечі, екхімоз, лейкопенія.
З боку метаболізму і харчування: гіпопротеїнемія, периферичні набряки.
З боку скелетно-м’язової системи: артроз, міалгія.
З боку центральної нервової системи: порушення ходи, тривожність, кататонічна реакція, дизартрія, галюцинації, гіпертонія, гіпокінезія, психоз, посилення рефлексів, порушення сну, відстрочена дискінезія, тремор.
З боку дихальної системи, органів грудної клітки та середостіння: гикавка, риніт.
З боку шкіри та підшкірної клітковини: дискоїдний червоний вовчак, нодозна еритема, фурункульоз, макулопапульний висип, свербіж, висип, себорея, потовиділення, везикульозно- бульозний висип.
З боку органів зору, органів чуття: кон’юнктивіт, сухість очей, порушення зору, болі у ділянці очей, фотофобія, дисгевзія.
З боку сечовидільної системи: цистит, інфекція сечовивідних шляхів, порушення менструального циклу, вагініт.
Епілепсія
На підставі наявного дослідження ад’ювантної терапії для лікування складних парціальних нападів дівалпроекс натрієм, таблетки з модифікованим вивільнення, як правило, добре переносився, причому більшість побічних реакцій мали легкий та середній ступінь тяжкості. Непереносимість була основною причиною припинення лікування у пацієнтів, які приймали дівалпроекс натрію, таблетки з модифікованим вивільнення, порівняно з пацієнтами з групи плацебо.
Побічні реакції, зареєстровані у >5 % пацієнтів, які отримували вальпроат у ході плацебо- контрольованого дослідження ад’ювантної терапії складних парціальних нападів.
Загальні розлади: головний біль, астенія, пропасниця.
З боку травного тракту: нудота, блювання, абдомінальний біль, діарея, анорексія, диспепсія, запорі.
З боку нервової системи: сонливість, тремор, запаморочення, диплопія, амбліопія/розмитість зору, атаксія, ністагм, емоційна лабільність, патологічне мислення, амнезія.
З боку дихальної системи, органів грудної клітки та середостіння: грипоподібний синдром, інфекція, бронхіт, риніт.
Інше: алопеція, втрата маси тіла.
Оскільки пацієнти також приймали інші протиепілептичні лікарські засоби, у більшості випадків неможливо визначити, чи можуть наступні побічні реакції стосуватися тільки дівалпроекс натрію, таблетки з модифікованим вивільненням або комбінації дівалпроекс натрію, таблетки з модифікованим вивільненням з іншими протиепілептичними лікарськими засобами.
Побічні реакції, зареєстровані у >5 % пацієнтів із групи прийому високих доз у контрольованому дослідженні вальпроату для монотерапії складних парціальних нападів.
Загальні розлади: астенія.
З боку травного тракту: нудота, діарея, блювання, абдомінальний біль, анорексія, диспепсія.
З боку системи крові та лімфатичної системи: тромбоцитопенія, екхімоз.
З боку метаболізму і харчування: збільшення маси тіла, периферичний набряк.
З боку нервової системи: тремор, сонливість, запаморочення, безсоння, нервозність, амнезія, ністагм, депресія.
З боку дихальної системи, органів грудної клітки та середостіння: інфекція, фарингіт, диспное.
З боку шкіри та підшкірної клітковини: алопеція.
З боку органів зору: амбліопія/розмитість зору.
З боку органів слуху: шум у вухах.
Оскільки пацієнти також приймали інші протиепілептичні лікарські засоби під час першої частини дослідження, у багатьох випадках неможливо визначити, чи можуть наступні побічні реакції стосуватися тільки дівалпроекс натрію, таблетки з модифікованим вивільненням або комбінації вальпроату з іншими протиепілептичними лікарськими засобами.
Наступні додаткові побічні реакції відзначалися більш ніж у 1 %, але менш ніж у 5 %о пацієнтів, які отримували вальпроат у контрольованих дослідженнях складних парціальних нападів.
Загальні розлади: біль у спині, біль у грудній клітці, нездужання.
З боку серцево-судинної системи: тахікардія, артеріальна гіпертензія, посилене серцебиття.
З боку травного тракту: збільшення апетиту, метеоризм, гематемезис, відрижка, панкреатит, періодентальний абсцес.
З боку системи крові та лімфатичної системи: петехія.
З боку метаболізму і харчування: підвищення рівнів ACT, АЛТ.
З боку кістково-м’язової системи: міалгія, різкі скорочення м’язів, артралгія, судоми у ногах, міастенія.
З боку нервової системи: тривожність, сплутаність свідомості, порушення ходи, парестезія, гіпертонія, втрата координації, аномальні думки, розлад особистості.
З боку дихальної системи, органів грудної клітки та середостіння: синусит, збільшення кашлю, пневмонія, носова кровотеча.
З боку шкіри та підшкірної клітковини: висип, свербіж, сухість шкіри.
З боку органів зору, органів чуття, органів слуху та рівноваги: дисгевзія, розлади зору, глухота, середній отит.
З боку сечовидільної системи: нетримання сечі, вагініт, дисменорея, аменорея, часте сечовипускання.
Мігрень
Виходячи з наявних даних двох плацебо-контрольованих клінічних досліджень та їх довготривалого продовження, вальпроат, як правило, добре переносився. Більшість побічних реакцій оцінювались як легкі або середні за ступенем тяжкості. З пацієнтів, які приймали вальпроат у дослідженнях, 17 % припинили прийом внаслідок непереносимості. З урахуванням довготривалого додаткового дослідження, побічними реакціями, були алопеція (6 %), нудота та/або блювання (5 %), збільшення маси тіла (2 %), тремор (2 %), сонливість (1 %), підвищений рівень ACT та/або АЛТ (1 %), депресія (1 %).
Побічні реакції, повідомлені >5 % пацієнтів, які приймали дівалпроекс натрію, таблетки пролонгованої дії під час дослідження мігрені з більшою частотою, ніж пацієнти, які приймали плацебо.
З боку травного тракту: нудота, диспепсія, діарея, блювання, абдомінальний біль.
З боку нервової системи: сонливість.
Інше: інфекція.
Наступні додаткові побічні ефекти відзначалися у більш ніж 1 %, але не більше 5 % пацієнтів, які отримували дівалпроекс натрію, таблетки пролонгованої дії, та з більшою частотою, ніж плацебо, у ході клінічного дослідження щодо профілактики мігрені.
Загальні розлади: випадкова травма, вірусна інфекція.
З боку травного тракту: збільшення апетиту, захворювання зубів.
З боку метаболізму і харчування: набряк, збільшення маси тіла.
З боку нервової системи: порушення ходи, запаморочення, гіпертонія, безсоння, нервозність, тремор, вертиго.
З боку дихальної системи, органів грудної клітки та середостіння: фарингіт, риніт.
З боку шкіри та підшкірної клітковини: висип.
З боку органів слуху та рівноваги: шум у вухах.
Нижче наведені ті побічні реакції, про які повідомляли пацієнти у ході плацебо- контрольованих досліджень, де рівень захворюваності у групі вальпроату перевищував понад 5 % порівняно з групою плацебо.
З боку травного тракту: нудота, диспепсія, діарея, блювання, абдомінальний біль, збільшення апетиту.
З боку нервової системи: астенія, сонливість, запаморочення, тремор.
Інше: збільшення маси тіла, біль у спині, алопеція.
Наступні додаткові побічні реакції зареєстровано у більш ніж 1 % пацієнтів, але не більше ніж у 5 % пацієнтів, які отримували вальпроат у ході контрольованих клінічних досліджень.
Загальні розлади: біль у грудях.
З боку серцево-судинної системи: вазодилатація.
З боку травного тракту: запор, сухість у роті, метеоризм і стоматит.
З боку системи крові та лімфатичної системні: екхімоз.
З боку метаболізму і харчування: периферичний набряк.
З боку опорно-рухового апарату: судоми у литках.
З боку нервової системи: аномальні думки, сплутаність свідомості, парестезія, розлади мовлення та порушення мислення.
З боку дихальної системи, органів грудної клітки та середостіння: диспное та синусит.
З боку шкіри та підшкірної клітковини: свербіж.
З боку сечостатевої системи: метрорагія.
Наступні побічні реакції були виявлені під час післяреєстраційного застосування дівалпроекс натрію, таблетки з модифікованим вивільненням. Оскільки про ці реакції повідомляють добровільно щодо популяції невизначеного розміру, не завжди можливо достовірно оцінити їх частоту або встановити причинно-наслідковий зв’язок із впливом препаратів.
З боку шкіри та підшкірної клітковини: зміни текстури волосся, зміни кольору волосся, фоточутливість, мультиформна еритема, токсичний епідермальний некроліз, хвороби нігтя і нігтьового ложа, синдром Стівенса-Джонсона.
З боку психіки: емоційне засмучення, психоз, агресія, психомоторна гіперактивність, ворожість, порушення уваги, порушення здатності до навчання та погіршення поведінки.
З боку нервової системи: було декілька повідомлень про гостре або підгостре зменшення когнітивної здатності і зміни поведінки (апатія або дратівливість) із псевдоатрофією мозку при візуалізації, пов’язаної з лікуванням вальпроатом. Когнітивно-поведінкові зміни та церебральна псевдоатрофія бути частково або повністю оборотними після відміни вальпроату.
Повідомляли про гостру або підгостру енцефалопатію без підвищення рівня амонію, підвищеного рівня вальпроату або нейровізуалізаційних змін. Після відміни вальпроату енцефалопатія зникала частково або повністю.
З боку опорно-рухового апарату: переломи, зниження мінеральної щільності кісток, остеопенія, остеопороз та слабкість.
З боку системи крові та лімфатичної системи: відносний лімфоцитоз, макроцитоз, лейкопенія, анемія, у т.ч. макроцита з дефіцитом фолатів або без нього, пригнічення функції кісткового мозку, панцитопенія, апластична анемія, агранулоцитоз та гостра періодична порфірія.
З боку ендокринної системи: нерегулярні менструації, вторинна аменорея, гіперандрогенізм, гірсутизм, підвищений рівень тестостерону, збільшення молочної залози, галакторея, набряк навколовушної залози, полікістоз яєчників, зниження концентрації карнітину, гіпонатріємія, гіпергліцинемія та неадекватна секреція АДГ.
Рідко повідомляли про синдром Фанконі, що виникає переважно у дітей.
З боку метаболізму і харчування: збільшення маси тіла.
З боку репродуктивної системи: аспермія, азооспермія, зменшення кількості сперматозоїдів, зниження рухливості сперматозоїдів, чоловіче безпліддя та патологічна морфологія сперматозоїдів.
З боку сечовидільної системи: енурез та інфекція сечовидільних шляхів.
З боку органів слуху та рівноваги: втрата слуху.
Інше: алергічна реакція, анафілаксія, затримка розвитку, біль у кістках, брадикардія та шкірний васкуліт.
Термін придатності Теравас
2 роки.
Умови зберігання Теравас
Зберігати при температурі не вище 25 °С.
Зберігати у недоступному для дітей місці.
Упаковка
По 100 таблеток у контейнері. По 1 контейнеру в картонній коробці.
Категорія відпуску
За рецептом.
Виробник
Д-р Редді’с Лабораторіє Лімітед.
Місцезнаходження виробника
Дільниця № 41, с. Бачупалі, Бачупалі Мандал, округ Медчал Малкайгірі, Телангана 500090, Індія (IND).
Повідомити про побічну реакцію або відсутність ефективності при застосуванні лікарського засобу Ви можете за телефонами (цілодобово): +380 44 207 51 97 або +380 50 414 39 39
Подальша інформація
Пам'ятайте, зберігайте ці та всі інші ліки в недоступному для дітей місці, ніколи не передавайте свої ліки іншим і використовуйте Теравас тільки за призначенням.
Завжди консультуйтеся зі своїм лікарем, щоб переконатися, що інформація, яка відображається на цій сторінці, може бути застосована до ваших особистих обставин.
Увага! Ця інструкція для медичного застосування лікарського засобу є офіційною інструкцією виробника ТОВ «Др. Редді’с Лабораторіз».
Авторське право:
- http://www.drreddys.ua - ТОВ «Др. Редді’с Лабораторіз»
- http://www.drlz.com.ua - Державний реєстр ЛЗ України
| Тип даних | Відомості з реєстру |
| Торгівельне найменування: | Теравас |
| Виробник: | ТОВ «Др. Редді’с Лабораторіз» |
| Форма випуску: | таблетки пролонгованої дії по 250 мг або 500 мг, по 100 таблеток у контейнері; по 1 контейнеру в картонній коробці |
| Реєстраційне посвідчення: | UA/18012/01/01, UA/18012/01/02 |
| Дата початку: | 06.05.2020 |
| Дата закінчення: | 05.06.2025 |
| Міжнародне непатентоване найменування: | Valproic acid |
| Умови відпуску: | за рецептом |
| Склад: | 1 таблетка містить дівалпроекс натрію у перерахуванні на вальпроєву кислоту 250 мг або 500 мг |
| Фармакотерапевтична група: | Протиепілептичні засоби. |
| Код АТС: | N03AG01 |
| Заявник: | ТОВ «Др. Редді’с Лабораторіз» |
| Країна заявника: | Індія |
| Адреса заявника: | 8-2-337, Роуд № 3, Банджара Хіллз, Хайдерабад, Телангана - 500 034, Індія |
| Тип ЛЗ: | Звичайний |
| ЛЗ біологічного походження: | Нi |
| ЛЗ рослинного походження: | Нi |
| Гомеопатичний ЛЗ: | Нi |
| Тип МНН: | Моно |
| Дострокове припинення | Нi |
| Код ATC | Назва групи |
| N | Засоби, що діють на нервову систему |
| N03 | Протиепілептичні засоби |
| N03A | Протиепілептичні засоби |
| N03AG | Похідні жирних кислот |
| N03AG01 | Кислота вальпроєва |

