Хронічна серцева недостатність
Серцева недостатність
Серцева недостатність — це клінічний синдром, який ґрунтується на нездатності серця як насосу забезпечити постачання органів і тканин кров’ю в обсязі, необхідному для їх нормального метаболізму. Іншими словами, при серцевій недостатності розвивається невідповідність між продуктивністю серця і потребою тканин у кисні та поживних речовинах. Відповідно до визначення, наведеного в Рекомендаціях ЄТК (2001), серцеву недостатність варто розглядати як "патофізіологічний синдром, за якого внаслідок того або іншого захворювання серцево-судинної системи відбувається зниження насосної функції серця, що призводить до дисбалансу між гемодинамічною потребою організму й можливостями серця".
Критеріями серцевої недостатності є:
1) зниження ХОС;
2) циркуляторна гіпоксія зі збільшенням артеріовенозної різниці за киснем;
3) венозний застій, тобто підвищення тиску на шляхах кровотоку до одного або обох шлуночків серця.
Серцева недостатність означає нездатність підтримувати адекватний серцевий викид і забезпечення його нормального рівня за рахунок напруження компенсаторних механізмів, насамперед, збільшення кінцево-діастолічного об’єму (КДО) і кінцево-діастолічного тиску (КДТ) у шлуночку відповідно до механізму Франка—Старлінґа. У першому випадку це явна, а в другому — прихована (субклінічна) серцева недостатність.
Зниження насосної функції серця, тобто ХОС, буває абсолютним і відносним. Відносне зменшення ХОС може бути зумовлене первинним підвищенням метаболічних запитів органів і тканин, наприклад, при тиротоксикозі, або зниженням кисневотранспортної функції крові при анемії (варіант серцевої недостатності з високим ХОС). Слід зазначити, що для ранніх стадій серцевої недостатності характерний незмінений рівень ХОС у стані спокою, що, однак, не здатний достатньою мірою підвищуватися при зростанні метаболічних потреб тканин в умовах фізичного або емоційного напруження.
Епідеміологія. Дані американських і європейських епідеміологічних досліджень свідчать про те, що хронічна серцева недостатність є одним з найпоширеніших і прогностично несприятливих станів. Результати відомого Фремінгемського дослідження, виконаного в США, показали, що в популяції осіб віком понад 45 років кількість хворих із клінічно вираженою хронічною серцевою недостатністю становить приблизно 2,5%. Частота цього синдрому збільшується з віком. Так, якщо в популяції людей віком 50— 59 років його частота становить 1%, то у віці понад 80 років його частота сягає 10%. Хронічна серцева недостатність є однією з найчастіших причин госпіталізації і смертності населення земної кулі.
У міжнародних клініко-епідеміологічних дослідженнях показано, що останніми десятиліттями показник виявляння хронічної серцевої недостатності різко зростає, що пов’язують із "постарінням" населення, поліпшенням діагностики й лікування захворювань серцево-судинної системи, які призводять до розвитку хронічної серцевої недостатності (насамперед, ІХС, інфаркт міокарда, артеріальна гіпертензія). Прогноз при хронічній серцевій недостатності залишається несприятливим. Летальність при клінічно вираженій хронічній серцевій недостатності становить 40—66% на рік, перевершуючи таку, наприклад, від бронхогенного раку легень і раку передміхурової залози й корелює зі ступенем вираженості синдрому, становлячи при СН IV ФК 50%, при III ФК 40% і II ФК 30% на рік.
Етіологія. Хронічна серцева недостатність може ускладнювати перебіг будь-якого захворювання серця. Однак найчастішими причинами її розвитку є ІХС й артеріальна гіпертензія. При хронічній серцевій недостатності спостерігаються порушення основних функцій серця: скорочення (систолічна дисфункція) і/або розслаблення (діастолічна дисфункція).
Згідно із сучасною нейрогуморальною теорією, хронічна серцева недостатність розвивається за єдиними патофізіологічними законами незалежно від етіології ушкодження міокарда.
Основні причини
Основними причинами хронічної серцевої недостатності з переважно систолічною дисфункцією шлуночків є:
1) вогнищеві ураження міокарда зі зменшенням маси життєздатного міокарда: інфаркт міокарда, постінфарктний кардіосклероз і дифузний кардіосклероз;
2) дифузні ураження міокарда: міокардити й значна частина кардіоміопатій, у тому числі ятрогенних.
Головними причинами хронічної серцевої недостатності з первинним розвитком діастолічної дисфункції є захворювання, що супроводжуються порушенням наповнення шлуночків серця:
1) стеноз лівого або правого передсердно-шлуночкових отворів;
2) констриктивний і ексудативний перикардити, кіста або пухлина перикарда;
3) захворювання з підвищеною жорсткістю камери й (або) міокарда шлуночків унаслідок його гіпертрофії, поширеного фіброзу (склерозу) або інфільтративного ураження: артеріальна гіпертензія, рестриктивна кардіоміопатія (ендоміокардіальний фіброз), амілоїдоз та інші інфільтративні ураження міокарда, фіброеластоз, деякі випадки ІХС.
Патогенез. Розгорнутій клінічній картині серцевої недостатності зазвичай передує більш-менш тривалий період безсимптомної дисфункції лівого шлуночка, що забезпечується завдяки включенню серцевих і периферійних механізмів підтримання його насосної функції.
Серцеві компенсаторні механізми полягають у збільшенні ЧСС і скоротливості міокарда внаслідок адренергічної стимуляції та збільшення венозного повернення крові, що спричинює збільшення КДО й КДТ у шлуночках серця. Наростання КДТ, з одного боку, сприяє збереженню серцевого викиду за рахунок включення механізму Франка—Старлінґа, з іншого — призводить до збільшення напруження стінки шлуночка (міокардіального стресу). Для його нормалізації відповідно до рівняння Лапласа: 5=PV/h (8 — кінцево- діастолічне напруження стінки шлуночка, Р — кінцево-діастолічний тиск, V — кінцево-діастолічний об’єм, h — товщина стінки шлуночка) розвивається гіпертрофія міокарда, що також сприяє збереженню його скоротливої здатності. Серцеві механізми компенсації тісно взаємопов’язані між собою і реалізуються під впливом циркулюючих і місцевих нейрогормонів (ренін, альдостерон, ендотелій, вазопресин, брадикінін, простагландин, азоту оксид, натрійуретичні пептиди, прозапальні цитокіни та ін.) і порушень експресії генів, відповідальних за синтез колагенового матриксу.
Гіпертрофія міокарда, спочатку компенсаторна, призводить до зменшення розслаблення та підвищення жорсткості міокарда з погіршенням діастолічного наповнення шлуночка через порушення обміну кальцію і відкладення колагену в міжклітинному просторі. Зниження щільності Р-адренорецепторів і порушення скоротливої здатності гіпертрофованих кардіоміоцитів через порушення синтезу скоротливих білків може призводити також до систолічної дисфункції. Негативний вплив на насосну функцію шлуночка справляє також погіршення коронарної перфузії при гіпертрофії лівого шлуночка внаслідок збільшення дифузної відстані для кисню між капілярами й кардіоміоцитами й зменшення ендотелійзалежної вазодила- тації.
Периферійні компенсаторні механізми спрямовані на протидію зниженню AT й перфузії тканин і сприяють підвищенню активності вазоконстриктор- них нейрогормонів (симпатико-адреналової системи, ренін-ангіотензинової системи, ендотеліну й вазопресину), антидіуретичного гормону й зменшенню спорідненості гемоглобіну до кисню.
Зменшення подразнення барорецепторів аорти як наслідок зниження серцевого викиду, а також активація реніну, що розвивається в разі погіршення перфузії нирок, призводять до активізації симпатичної частини вегетативної нервової системи й найважливіших гуморальних регуляторних систем. При цьому стимуляція р,-адренорецепторів сприяє підвищенню скоротливості міокарда й ЧСС, а а,-адренорецепторів — звуженню артеріол (підтримання AT) і вен (збільшення венозного кровотоку до серця). Підвищення тиску в лівому передсерді, що розвивається при систолічній і діастолічній дисфункції лівого шлуночка, стимулює секрецію передсердного натрійуретичного пептиду (гормону), а підвищення міокардіального стресу в шлуночках — секрецію так званого мозкового натрійуретичного пептиду. Ці біологічно активні речовини сприяють збільшенню натрійурезу й діурезу, протидіють констрикторному впливові на судини норадреналіну й ангіотензину II і зменшують секрецію альдостерону.
При реалізації дії чинників компенсації поряд з корисними відзначають більш-менш виражені несприятливі ефекти, які за певних умов починають переважати. Так, тривала вазоконстрикція сприяє прогресивному погіршенню функції ендотелію, що посилює звуження судин, зниженню швидкості клубочкової фільтрації, а порушення функції скелетних м’язів впливає на здатність виконувати фізичне навантаження. При розширенні камери лівого шлуночка під час реалізації механізму Франка—Старлінґа й розтягненні його міокарда понад певну величину приріст ударного викиду припиняється і він навіть починає знижуватися, що супроводжується значним підвищенням тиску на шляхах кровотоку з розвитком транссудації рідкої частини плазми в комірки (альвеоли).
Активізація ренін-ангіотензин-альдостеронової системи, що спочатку сприяє збільшенню ударного об’єму за рахунок збільшення венозного кровотоку до серця, згодом призводить до зворотного результату — зниження ударного об’єму через різке підвищення постнавантаження. При цьому значне збільшення гідростатичного тиску в капілярах призводить до розвитку набряків, що може супроводжуватися зниженням концентрація Na+ у крові через виражене затримання води під впливом антидіуретичного гормону.
До несприятливих біологічних ефектів нейрогормональної активізації належать також пряме ушкодження кардіоміоцитів, їх апоптоз (загибель життєздатних клітин, спричинена "запуском" відповідної програми в разі порушення експресії генів). До зменшення маси життєздатних кардіоміоцитів призводять також активізація вільних радикалів 02, що справляють безпосередню ушкоджувальну дію на мембрани кардіоміоцитів і стимулюють їх апоптоз. Серцева недостатність супроводжується також розвитком неспецифічного асептичного з млявим перебігом системного імунного запалення. Активізація металопротеїназ, що виникає при цьому, сприяє руйнуванню в міокарді інтерстиціальної тканини і, як наслідок, активізації фіброзу й замісного склерозу.
Важливе значення в компенсації симптомів хронічної серцевої недостатності має вповільнення швидкості кровотоку, що створює сприятливі умови для збільшення віддачі кисню і поживних речовин крові тканинам і проявляється збільшенням артеріовенозної різниці за киснем. Цьому ж сприяє зменшення спорідненості гемоглобіну до кисню в умовах гіпоксії та ацидозу.
На ранніх стадіях хронічної серцевої недостатності компенсаторні механізми забезпечують підтримання нормального ХОС і тиску в порожнинах серця як у стані спокою, так і під час фізичного навантаження. Надалі при збереженні компенсації в стані спокою виникає її зрив під час навантаження (менший приріст ХОС, зниження ударного об’єму й фракції викиду й підвищення КДТ у шлуночку). У розгорнутій стадії декомпенсації збільшення КДО й КДТ ураженого шлуночка відзначається й у стані спокою. У разі переважного порушення систолічної функції ці показники зростають паралельно один до одного, часто з більшим приростом КДО, що супроводжується зниженням фракції викиду, тоді як для первинної діастолічної дисфункції характерні значне збільшення КДТ і тиску крові на шляхах кровотоку до шлуночка при незміненому їх КДО й фракції викиду.
Спостерігають порушення
При хронічній серцевій недостатності спостерігають також виражені порушення метаболізму міокарда, які включають:
1) порушення утилізації енергії, тобто перетворення хімічної енергії АТФ на механічну енергію скорочення міокарда внаслідок зменшення активності Са2+-залежної АТФази міозину;
2) порушення поєднання збудження зі скороченням, що призводить до зменшення кількості Са2+, які надходять у клітину при її деполяризації;
3) порушення утворення енергії, тобто окисного фосфорилювання, з виснаженням запасів макроергічних фосфатів — АТФ і креатинфосфату.
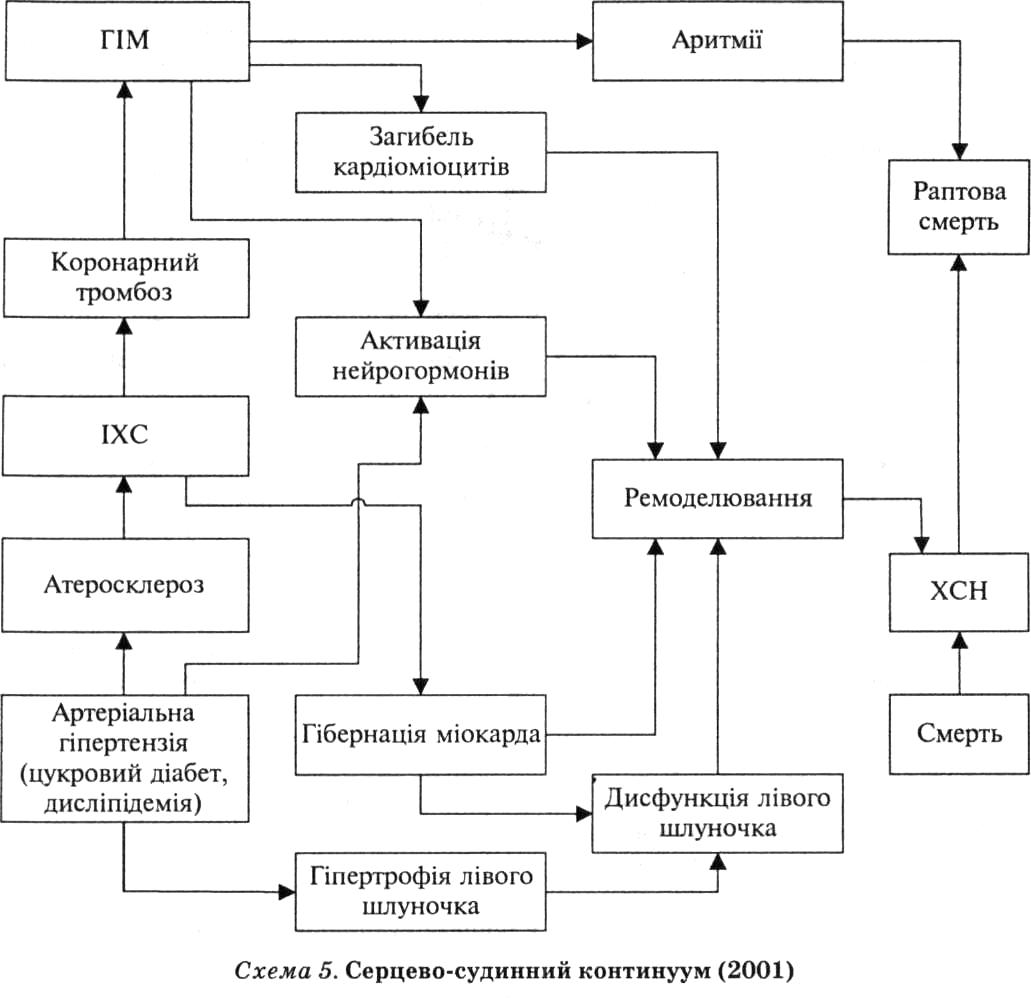
На Європейському конгресі кардіологів у 2001 р. було запропоновано теорію єдиного серцево-судинного континуума, або безперервного розвитку серцево-судинних захворювань від чинників ризику до загибелі хворого (схема 5). Відповідно до цієї концепції, основними чинниками ризику хронічної серцевої недостатності є артеріальна гіпертензія, дисліпідемія і діабет, які індукують розвиток ІХС, у тому числі інфаркт міокарда. Наслідком цих станів є гіпертрофія міокарда лівого шлуночка, гібернація (потенційно оборотна дисфункція внаслідок недостатнього кровопостачання) і/або загибель кардіоміоцитів з наступною дисфункцією лівого шлуночка серця і його ремоделюванням.
Ремоделювання лівого шлуночка є патоморфологічним субстратом хронічної серцевої недостатності і включає зміну форми й(або) величини його порожнини, маси, структури, ультраструктури й метаболізму міокарда, що виникає у відповідь на первинне ушкодження міокарда (наприклад, при ІХС) або функціонування в умовах перевантаження об’ємом й(або) опором (наприклад, при клапанних вадах серця).
Головними ознаками ремоделювання лівого шлуночка серця є його гіпертрофія, дилатація камери (збільшення КДО) і втрата еліптичності зі сферизацією порожнини, асинхронним скороченням міофібрил і руйнуванням сполучнотканинного каркасу міокарда.
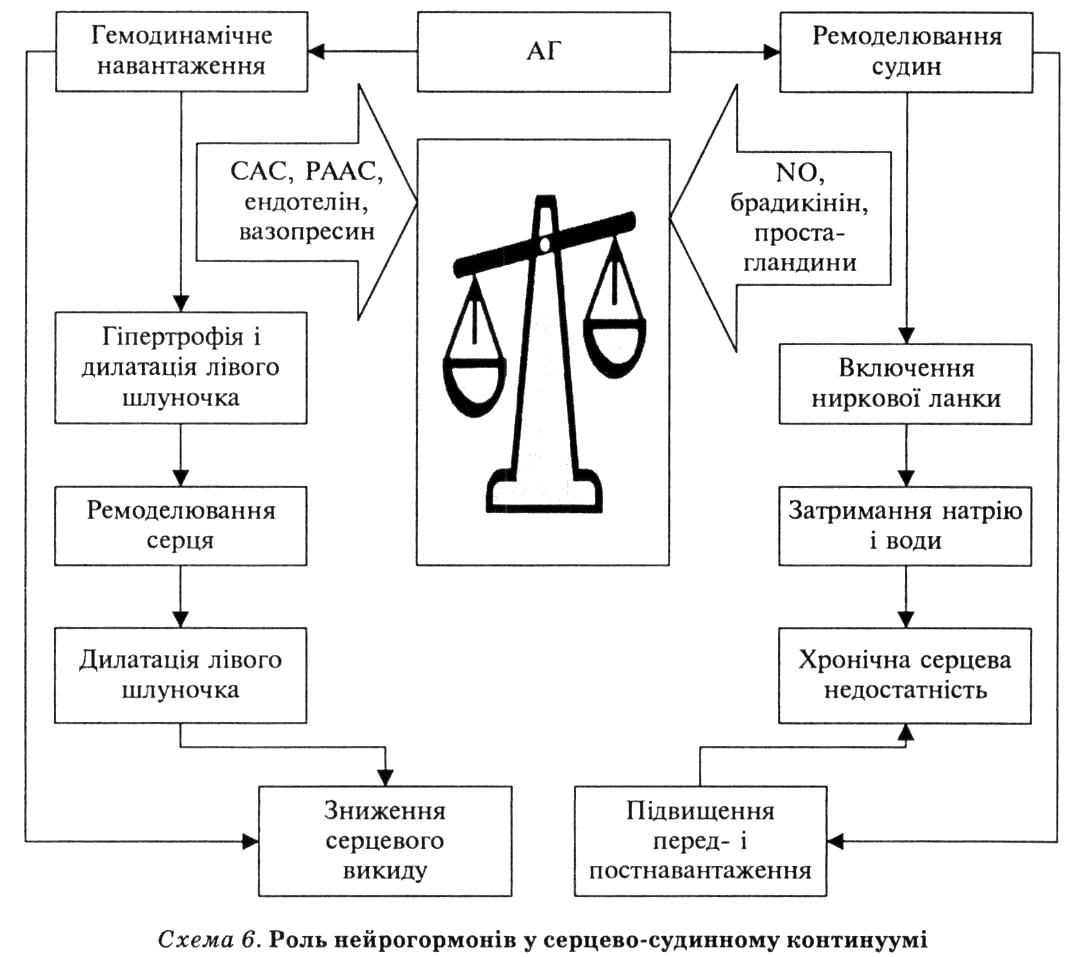
Однією з головних причин ремоделювання є гіперактивація нейрогор- монів (схема 6). Відповідно до концепції серцево-судинного континуума, при хронічній серцевій недостатності варто говорити не про надмірну активізацію нейрогормональних систем, а про дисбаланс активності двох груп нейрогормональних чинників:
1) чинників проліферації клітин (кардіоміоцитів і клітин інтерстиціальної тканини), їхнє ушкодження і, як наслідок, ремоделювання шлуночків (ренін-ангіотензинова й симпатико-адреналова системи, ендотелій, вазопресин);
2) вазодилатаційних, діуретичних й антипроліферативних чинників (NO-ендотеліальний релаксаційний чинник, натрійуретичні пептиди, брадикінін, простациклін).
Більшості захворювань серцево-судинної системи властивий дисбаланс активності нейрогормонів у бік переважання чинників першої групи, що сприяє прогресуванню ремоделювання і хронічної серцевої недостатності.
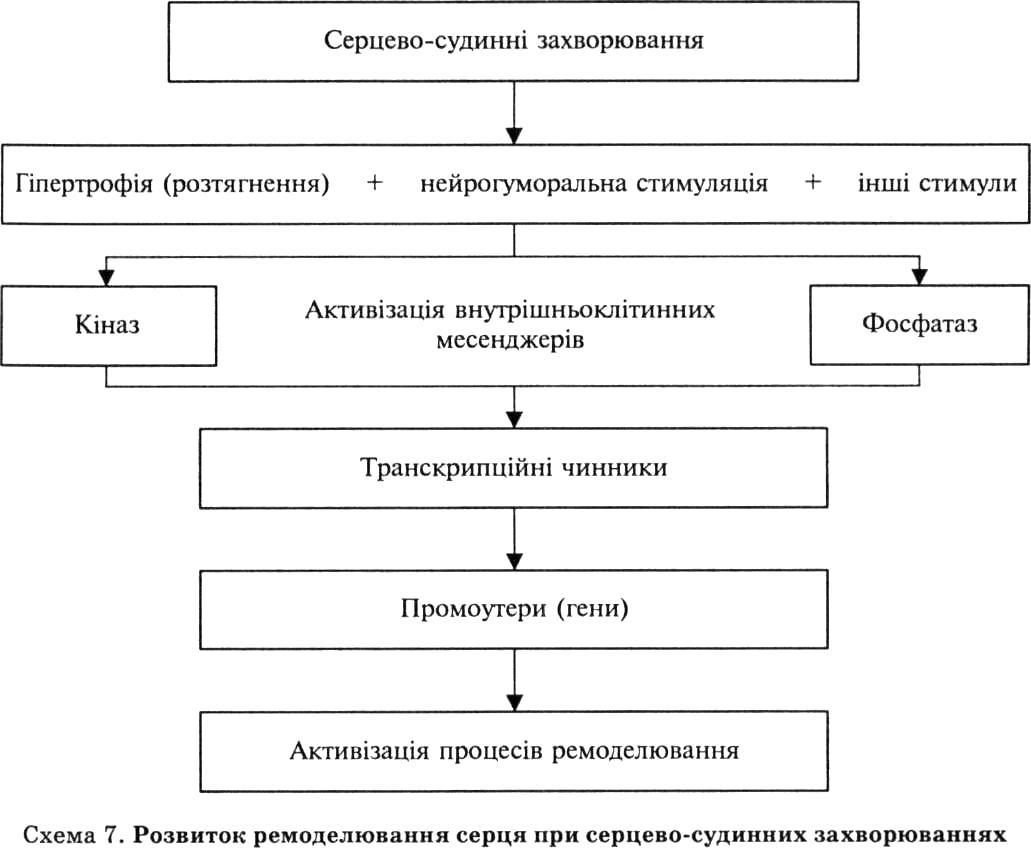
Відповідно до сучасних уявлень, різні серцево-судинні захворювання активізують нейрогормональні системи, спричинюють порушення гемодинаміки й деякі інші чинники (схема 7). У підсумку відбувається стимуляція внутрішньоклітинних месенджерів, зокрема внутрішньоклітинних ферментних систем (кінази і фосфатази). Зміни активності внутрішньоклітинних ферментів запускають транскрипційні чинники, що впливають на гени-промоутери, унаслідок чого змінюється експресія генів й активізуються процеси ремоделювання серця.
Два типи ремоделювання
Виділяють два типи ремоделювання лівого шлуночка серця:
1. Концентричний тип, який найчастіше розвивається в разі перевантаження тиском (артеріальна гіпертензія) і проявляється гіпертрофією міокарда лівого шлуночка без дилатації його порожнини. Характеризується відносно сприятливим перебігом, тривалим збереженням фракції викиду лівого шлуночка на нормальному рівні, часто наявністю асимптоматичної діастолічної дисфункції.
2. Ексцентричний тип, який розвивається в разі перевантаження лівого шлуночка об’ємом (вади серця з регургітацією, ІХС, дилатаційна кардіоміопатія) і проявляється гіпертрофією міокарда лівого шлуночка з дилатацією порожнини без стовщення стінок лівого шлуночка. Перебіг цього типу ремоделювання є менш сприятливим. Він супроводжується зниженням фракції викиду в міру прогресування розширення порожнини шлуночка.
Перехід від концентричного типу ремоделювання до ексцентричного відбувається в разі приєднання перевантаження об’ємом (імовірно, з появою регургітації на мітральному клапані) або збільшення ішемії міокарда.
Класифікація серцевої недостатності
Класифікація хронічної серцевої недостатності
Протягом багатьох років у нашій країні застосовували класифікацію М.Д. Стражеска і В.Х. Василенка, прийняту на XII з’їзді терапевтів у 1935 р. Вона передбачає виділення гострої і хронічної недостатності кровообігу. Гостра недостатність кровообігу включає синдроми гострої серцевої, судинної, серцево-судинної, лівошлуночкової і правошлуночкової недостатності. Стадії хронічної недостатності кровообігу відображують послідовність її прогресування.
У І стадії симптоми недостатності кровообігу з’являються тільки під час підвищеного фізичного навантаження, у стані спокою гемодинаміка і функції серця не порушені. У II стадії виділяють два періоди. Період А — початок тривалої стадії, що характеризується появою симптомів недостатності кровообігу під час звичайного фізичного навантаження. У період Б симптоми відзначаються під час незначного фізичного навантаження і в стані спокою. Характерні виражені порушення функцій усіх відділів серця. Працездатність втрачена. У III стадії порушення гемодинаміки в стані спокою різко виражені. Відзначаються необоротні дистрофічні зміни всіх органів і тканин і стійкі порушення їхнього функціонування.
Загальноприйнятою є класифікація хронічної серцевої недостатності Нью-Йоркської асоціації серця (NYHA, 1973), що грунтується на клінічному оцінюванні наявності і вираженості обмеження функціонального стану хворих, тобто їхньої толерантності до повсякденного фізичного навантаження. Якість життя хворого оцінюють за шкалою функціональних класів (ФК).
Класифікація СН, яка рекомендована ЄТК (2001), базується на класифікації М.Д. Стражеска і В.Х. Василенка та NYHA і передбачає виділення клінічних стадій, функціональних класів і варіантів серцевої недостатності.
Клінічні стадії (відповідають стадіям хронічної недостатності кровообігу за класифікацією М.Д. Стражеска і В.Х. Василенка, 1935):
СН І — початкова стадія, задишка під час підвищеного фізичного навантаження, якої раніше не було.
СН НА — клінічно виражена стадія, задишка під час помірного фізичного навантаження.
СН ІІБ — симптоми під час незначного фізичного навантаження і в стані спокою, втрата працездатності.
СН III — кінцева стадія ураження серця з вираженими змінами гемодинаміки й необоротними структурними змінами органів.
Функціональні класи (за критеріями NYHA, 1973):
ФК І — виконання звичайних фізичних навантажень не спричинює задишки, втомлюваності або серцебиття.
ФК II — задишка, втомлюваність, серцебиття з’являються під час звичайних фізичних навантажень, що спричинює помірне обмеження фізичної активності.
ФК III — у стані спокою скарг немає, але навіть за незначного фізичного навантаження виникають задишка, втомлюваність і серцебиття (виражене обмеження фізичної активності).
ФК IV — будь-який рівень фізичної активності спричинює суб’єктивні симптоми, які можуть виникати також і в стані спокою.
Варіанти:
— із систолічною дисфункцією лівого шлуночка: фракція викиду лівого шлуночка 45% і менше;
— зі збереженою систолічною функцією лівого шлуночка: фракція викиду лівого шлуночка більше ніж 45% (хворі з первинною діастолічною серцевою недостатністю і клапанними вадами з регургітацією, що спричинює "завищення" фракції викиду лівого шлуночка).
Стадії хронічної серцевої недостатності відображають етап клінічної еволюції цього синдрому, тоді як ФК пацієнта є динамічною характеристикою, що може змінюватися в процесі лікування. ФК хворого визначають на підставі клінічних критеріїв і об’єктивізують за даними максимального споживання кисню при дозованому фізичному навантаженні під час спіровелоергометрії. Визначення варіанта серцевої недостатності можливе лише за наявності даних ехокардіографічного обстеження чи радіоізотопної або рентгеноконтрастної вентрикулографії.
Клінічна картина. Діагноз хронічної серцевої недостатності ґрунтується на виявленні характерних симптомів цього синдрому при виключенні інших причин, не пов’язаних з патологією серця (захворювань легень, нирок, органів кровотворення та ендокринної патології).
Порушення систолічної функції лівого шлуночка клінічно проявляється симптомами застою в малому колі кровообігу внаслідок венозної легеневої гіпертензії — задишкою, ортопное, серцевою астмою. При порушенні скоротливості правого шлуночка з’являються симптоми застою у великому колі кровообігу — збільшення печінки, асцит, периферійні набряки, набрякання і пульсація яремних вен.
Задишка як симптом хронічної серцевої недостатності з’являється спочатку під час фізичної активності, а потім і в стані спокою. У положенні сидячи або лежачи з піднятим узголів’ям задишка зменшується, оскільки при цьому венозний кровотік до правих відділів серця зменшується. Саме збільшенням кровотоку до правих відділів серця можна пояснити розвиток нападів серцевої астми переважно вночі. При цьому крім задишки і ядухи відзначається сухий або з відділенням мізерного слизистого мокротиння кашель, під час аускультації прослуховуються хрипи в нижніх відділах легень.
Швидка втомлюваність під час фізичного навантаження свідчить про недостатнє кровопостачання скелетних м’язів, що почасти є наслідком вибіркової компенсаторної вазоконстрикції, описаної вище.
Серцебиття є одним із ранніх симптомів хронічної серцевої недостатності як спроба організму нормалізувати ХОС при зниженому ударному об’ємі серця спочатку під час фізичного навантаження, а потім і в стані спокою.
Периферійні набряки у хворих із хронічною серцевою недостатністю супроводжуються іншими симптомами затримання рідини (ніктурією, олігу- рію, збільшенням маси тіла), а їхня локалізація залежить від стадії синдрому. Спочатку з’являється пастозність стоп і ділянок кісточок наприкінці дня, що зникає до ранку, поступово набряки поширюються й можуть охоплювати все тіло (анасарка). Набряки зазвичай супроводжуються спрагою і значним споживанням рідини. Набряковий синдром може перебігати з гідротораксом, частіше правобічним, оскільки хворі із хронічною серцевою недостатністю сплять переважно на правому боці. Гідроторакс може бути ознакою венозного застою як у малому, так і великому колі кровообігу, тому що плевральні вени пристінкової плеври належать до великого кола, а нутрощевої плеври — до малого кола кровообігу.
Збільшення печінки при правошлуночковій недостатності передує появі набряків. Рідина в черевній порожнині (транссудат) з’являється внаслідок підвищеного тиску в печінкових венах і венах очеревини.
Відповідно до Європейського клініко-епідеміологічного дослідження IMPROVEMENT (2000), задишка різної вираженості відзначається в 98,4%, швидка втомлюваність — у 94,3%, серцебиття — у 80,4% хворих із хронічною серцевою недостатністю. Кашель, ортопное, периферійні набряки трапляються рідше, частота виявлення цих симптомів у хворих із хронічною серцевою недостатністю не перевищує 73%.
Практично всі симптоми хронічної серцевої недостатності зустрічаються і при інших захворюваннях, що зумовлює їх низьку специфічність. Діагностична цінність симптомів підвищується в разі поєднання кількох симптомів. Тому в кожному випадку діагноз хронічної серцевої недостатності повинен бути підтверджений даними об’єктивних методів (табл. 26).
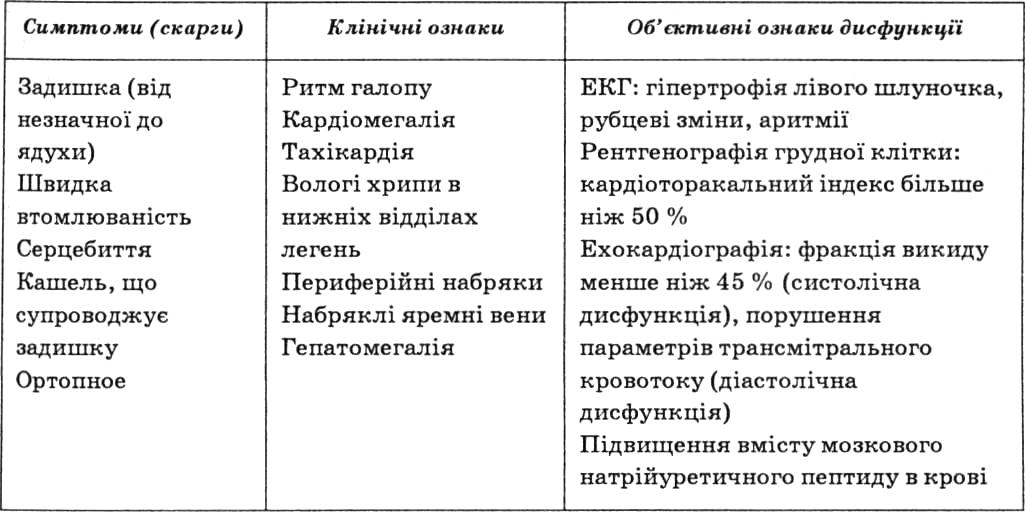
Діагностика
Діагностика. При електрокардіографії у 12 відведеннях найчастіше виявляють ознаки гіпертрофії і перевантаження лівого шлуночка, рубцеві зміни після перенесеного інфаркту міокарда, аритмії, особливо фібриляцію передсердь. Однак ці зміни неспецифічні. Найважливіше значення має нормальна ЕКГ, що свідчить про відсутність хронічної серцевої недостатності з точністю понад 90%.
Головними рентгенологічними ознаками хронічної серцевої недостатності є збільшення розмірів серця і венозний застій у легенях. Збільшення розмірів серця (кардіоторакальний індекс більше ніж 50%) характерне для систолічної серцевої недостатності, однак нормальні розміри не виключають діастолічної дисфункції. Ознаки венозного застою, інтерстиціального й альвеолярного набряку легень найчастіше свідчать про високий тиск "заклинювання" легеневої артерії і можуть відзначатися як при систолічній, так і при діастолічній дисфункції лівого шлуночка, однак чутливість цієї ознаки не перевищує 50%.
Ехокардіографія дає змогу об’єктивізувати наявність дисфункції лівого шлуночка, уточнити її характер (систолічна чи діастолічна) і вираженість, а також отримати важливу інформацію про характер захворювання серця як причини хронічної серцевої недостатності й оцінити ефективність лікування. Завдяки використанню цього методу можна визначити стан клапанного апарату (недостатність, регургітація, стеноз), зміни ендокарда (вегетації) і перикарда (рідина в порожнині перикарда), внутрішньопорожнинні тромби як вогнища тромбоемболії.
Найважливішим параметром внутрішньосерцевої гемодинаміки, що визначається під час ехокардіографії, є фракція викиду лівого шлуночка, яку використовують для оцінювання систолічної функції лівого шлуночка. При цьому вважають, що про наявність систолічної дисфункції лівого шлуночка свідчить фракція викиду менше ніж 45%.
За допомогою допплєрівського дослідження трансмітрального кровотоку в період діастоли можна отримати важливу інформацію про характер наповнення лівого шлуночка. Виявлення порушень діастолічного наповнення серця важливе не лише для визначення варіанта хронічної серцевої недостатності у кожному конкретному випадку. Доведено, що вираженість діастолічної дисфункції більшою мірою, ніж систолічної, корелює з тяжкістю перебігу синдрому, вираженістю зниження толерантності до фізичного навантаження і якістю життя.
Початкова стадія діастолічної дисфункції розвивається внаслідок порушень активного розслаблення міокарда й характеризується зниженням швидкості раннього трансмітрального потоку (Е), компенсаторним підвищенням швидкості потоку у фазі систоли передсердя (А) і зниженням співвідношення Е/А.
У пацієнтів з тяжким ураженням серця може спостерігатися рестриктивний тип наповнення лівого шлуночка зі збільшенням швидкості Е, укороченням часу вповільнення піка Е і значним збільшенням співвідношення Е/А. Збільшена швидкість раннього наповнення лівого шлуночка (Е) зумовлена збільшенням тиску в лівому передсерді, що призводить до збільшення раннього діастолічного трансмітрального градієнта тиску.
У пацієнтів із проміжним між порушеннями розслаблення і рестриктивним типом діастолічного наповнення лівого шлуночка співвідношення Е/А і час уповільнення можуть не відрізнятися від норми ("псевдонормальний тип" наповнення лівого шлуночка). Цей тип відрізняється від нормального зменшенням піка швидкості Е.
Три типи діастолічної дисфункції лівого шлуночка ("порушення розслаблення", "псевдонормальний" і "рестриктивний") відповідають легкому, середньому й тяжкому ступеням діастолічної дисфункції.
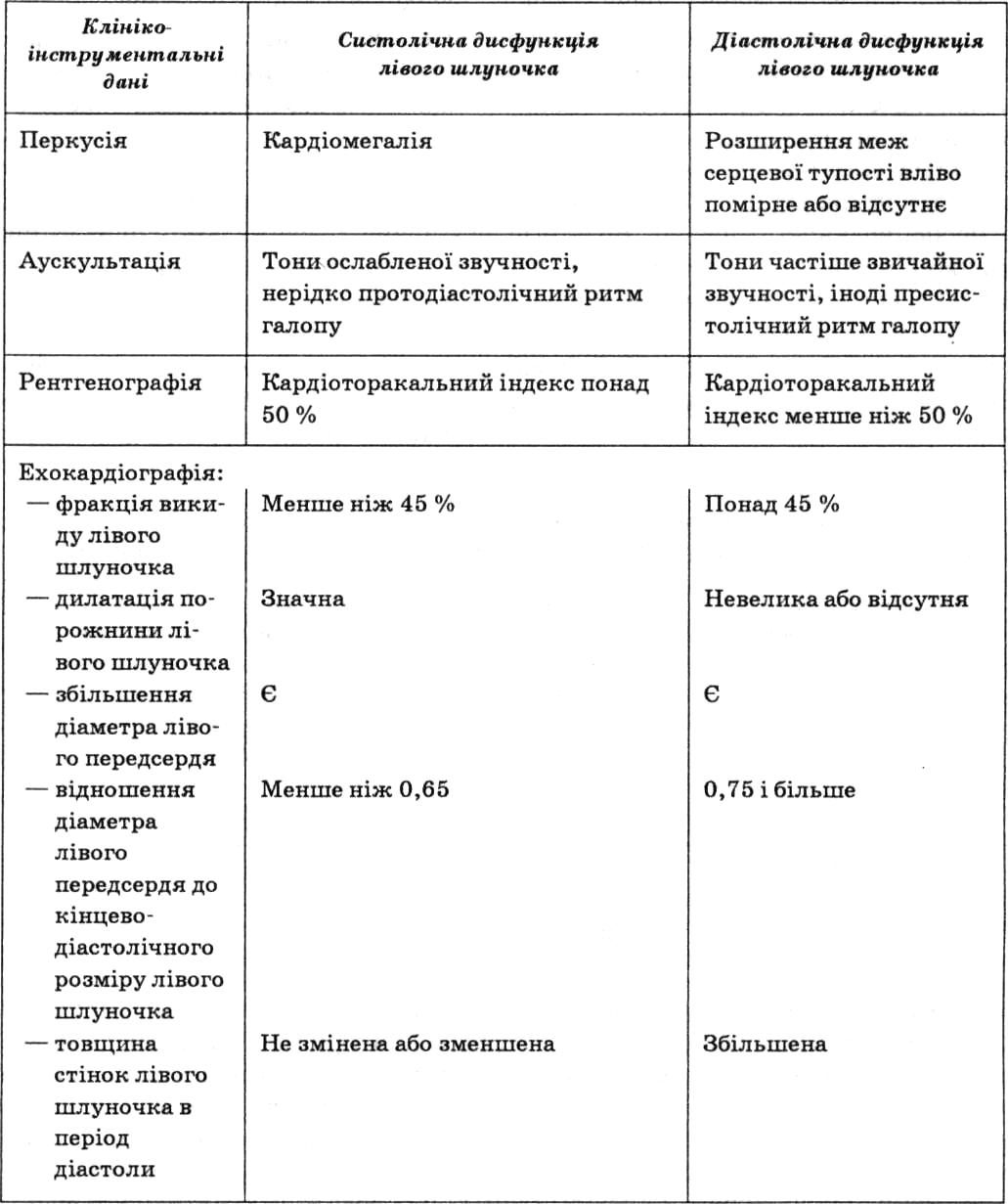
У табл. 27 подано основні критерії розмежування систолічної і діастолічної дисфункції лівого шлуночка.
Критерії розмежування систолічної і діастолічної дисфункції лівого шлуночка (за Л.Г. Воронковим, 2003, з доповненнями)

Магнітно-резонансна томографія і радіоізотопна ангіографія дають змогу точніше, порівняно з ехокардіографією, оцінити товщину стінок, масу міокарда лівого шлуночка, об’єми камер серця. Крім того, завдяки магнітно-резонансній томографії можна визначити кровопостачання міокарда, розміри некрозу міокарда або постінфарктного рубця. У хворих із хронічною серцевою недостатністю ці методи мають допоміжне значення і можуть застосовуватися в разі недостатньої інформативності інших методик, насамперед ехокардіографії.
Навантажувальні тести на велоергометрі або тредмілі в пацієнтів із хронічною серцевою недостатністю проводять для оцінювання їхнього функціонального стану й ефективності лікування. Найінформативнішим показником для оцінювання функціонального стану хворих із цим синдромом є максимальне споживання кисню під час фізичного навантаження. При хронічній серцевій недостатності спостерігають зниження цього показника, що, однак, є неспецифічною ознакою. Водночас незмінене максимальне споживання кисню виключає хронічну серцеву недостатність. Його величина менше ніж 10 мл кг-1 • хв засвідчує несприятливий прогноз.
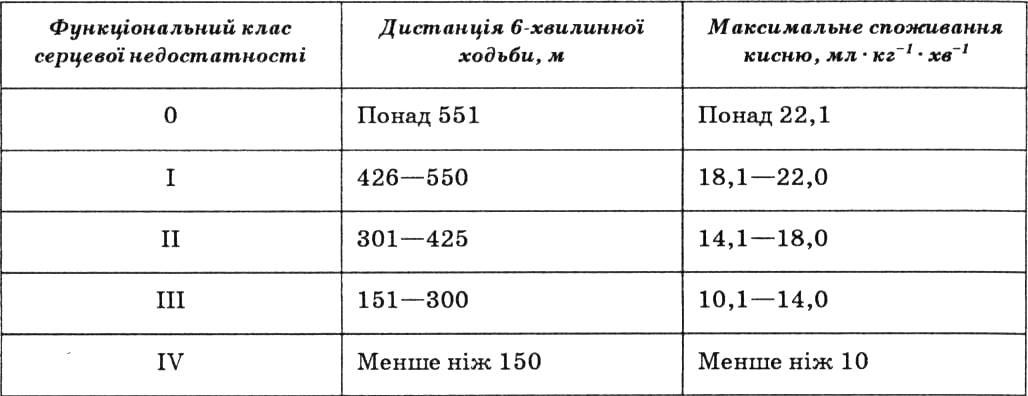
У практичній діяльності зручно користуватися рекомендованим NYHA тестом з ходьбою протягом 6 хв з максимально можливою швидкістю. Величина пройденої при цьому відстані високо корелює із ФК NYHA і прогнозом хворих із хронічною серцевою недостатністю (табл. 28).
Параметри фізичної активності при різній вираженості хронічної серцевої недостатності за критеріями Нью-Йоркської асоціації серця.
Інвазійні методи дослідження застосовують для встановлення причини хронічної серцевої недостатності й оцінювання прогнозу. Коронарну ангіографію варто проводити пацієнтам з гострою серцевою недостатністю або гострою декомпенсацією хронічної серцевої недостатності й пацієнтам з тяжкою серцевою недостатністю (шок або гострий набряк легень), які погано реагують на лікування. Коронаровентрикулографію слід проводити пацієнтам зі стенокардією або іншими ознаками ішемії міокарда за неефективності відповідної антиішемічної терапії, а також з рефрактерною серцевою недостатністю невідомої етіології.
Моніторування гемодинамічних показників за допомогою катетеризації легеневої артерії показано пацієнтам, які госпіталізовані з приводу кардіогенного шоку або не реагують на розпочату терапію.
Натрійуретичні пептиди. На сьогодні відомі 4 види натрійуретичних пептидів. Передсердний натрійуретичний пептид був відкритий у 1981 p., а в 1988 р. з мозкової тканини свині був виділений так званий мозковий натрійуретичний пептид. Згодом було доведено, що головним джерелом мозкового натрійуретичного пептиду є кардіоміоцити шлуночків серця. Його виділення в кров підвищується в разі посилення міокардіального стресу. Джерелом третього натрійуретичного пептиду (С-натрійуретичний пептид) є ендотеліальні клітини. Четвертий тип (Д-тип) натрійуретичного пептиду був виділений з отрути змії Green Mamba.
Нині визначення вмісту мозкового натрійуретичного пептиду в крові для уточнення діагнозу хронічної серцевої недостатності міститься в усіх міжнародних рекомендаціях. Його чутливість станобить 97%, специфічність 84% і прогностична цінність 70%, що дає змогу рекомендувати визначення концентрації мозкового натрійуретичного пептиду як лабораторний критерій хронічної серцевої недостатності.
У Рекомендації ЄТК (2001) визначення мозкового натрійуретичного пептиду за підозри на хронічну серцеву недостатність (наприклад, у хворих із задишкою) розглядається як перший етап діагностики, і в разі його підвищення (понад 100 пг/мл) рекомендовано подальше обстеження хворого, зокрема проведення ехокардіографії. Якщо вміст пептиду менше зазначеної величини, рекомендовано шукати інші причини задишки та інші симптоми хронічної серцевої недостатності — анемію, дихальну недостатність, передусім унаслідок хронічних обструктивних захворювань легень, ожиріння, ниркову недостатність, венозну недостатність.
Обстеження хворих з підозрою на хронічну серцеву недостатність і в разі встановлення цього діагнозу повинні включати проведення таких лабораторних досліджень: загальний аналіз крові й сечі, визначення рівнів креатиніну й глюкози, печінкових ферментів, концентрації електролітів плазми.
Анемія, що проявляється задишкою і швидкою втомлюваністю, часто є супутником хронічної серцевої недостатності (у 14—79% хворих). Її виникнення при хронічній серцевій недостатності пов’язують із характерним для цього синдрому хронічним неспецифічним імунним запаленням і, можливо, вторинним гастритом. Зниження гемоглобіну до показників менше ніж 110 г/л свідчить про тяжкий перебіг хронічної серцевої недостатності і підвищення ризику смерті. Анемія при хронічній серцевій недостатності зазвичай нор- моцитна, частіше її виявляють у пацієнтів із хронічною серцевою недостатністю III—IV ФК (NYHA), у жінок, а також у хворих із задавненою хронічною серцевою недостатністю (понад 7 років).
Під час лабораторного дослідження можуть визначатися ознаки гепато- цитолізу (підвищення активності аланінової та аспарагінової трансаміназ) і печінково-клітинної недостатності (підвищення вмісту фракцій білірубіну, зниження альбуміну й протромбінового індексу), зумовлені некрозом гепатоцитів в умовах порушення кровообігу й гіпоксії печінки.
Збільшення об’єму циркулюючої крові, уживання сечогінних засобів й обмеження солі у хворих із хронічною серцевою недостатністю можуть зумовити гіпокаліємію і гіпонатріємію.
Під час дослідження сечі можна виявити зміни, характерні для "застійної" нирки (висока відносна густина, різної вираженості протеїнурія при мізерному сечовому осаді). Зниження ниркового кровотоку через периферійний спазм в умовах вираженої нейрогуморальної активації може призводити до транзиторного, а при різко вираженій хронічній серцевій недостатності — стійкого підвищення креатиніну в крові, що вважають несприятливою прогностичною ознакою. Для точнішого оцінювання стану нирок у хворих із хронічною серцевою недостатністю рекомендовано розраховувати кліренс креатиніну за такими формулами:
Ускладнення
Ускладнення хронічної серцевої недостатності
Ускладнення внаслідок ураження органів дихання. У хворих із хронічною серцевою недостатністю внаслідок тісного анатомічного й функціонального взаємозв’язку між системами кровообігу й дихання часто спостерігаються поєднані зміни в цих системах, які корелюють з тяжкістю і вираженістю легеневої гіпертензії. Зміни функціонального стану апарату зовнішнього дихання виникають порівняно рано, часто до появи симптомів хронічної серцевої недостатності, спочатку носять компенсаторний характер і спрямовані на підтримання нормального газового складу крові. Надалі приєднуються структурні зміни легеневої тканини, збільшуються порушення функціонального стану апарату зовнішнього дихання, розвиваються розлади газового складу артеріальної крові.
Зниження максимальної вентиляції легень, ЖЄЛ, нерівномірність вентиляції при хронічній серцевій недостатності, що вкладаються в синдром рестриктивної дихальної недостатності, зумовлені підвищенням опору бронхів і зниженням розтяжності легень. Збільшення еластичного й нееластичного опору сприяє підвищенню внутрішньогрудного тиску, погіршенню умов гемодинаміки в малому колі кровообігу й наростанню роботи дихання, що підвищує потребу тканин у кисні, збільшує гіпервентиляцію і призводить до порушення дифузії газів.
Порушення вентиляції легень у поєднанні з порушеннями гемодинаміки в малому колі кровообігу, посткапілярною легеневою гіпертензією, застоєм і транссудацією рідкої частини плазми крові в комірки створюють сприятливі умови для інфекції і розвитку застійної пневмонії.

Характерне для хворих із хронічною серцевою недостатністю кровохаркання зумовлено діапедезом або розривом розширених легеневих і бронхових капілярів. Зрідка в разі розриву дрібних бронхових вен може виникнути легенева кровотеча. Є відносно раннім ускладненням лівобічної серцевої недостатності. Спостерігається у хворих із серцевою астмою, набряком легень, може бути зумовлена тромбоемболією гілок легеневої артерії.
Варто пам’ятати, що порушення функції зовнішнього дихання не специфічні. Вони характерні й для бронхолегеневих захворювань, анемій, тиротоксикозу.
Порушення серцевого ритму й раптова серцева смерть. Частота раптової серцевої смерті серед причин летальних наслідків хворих із застійною серцевою недостатністю коливається від 45 до 90%. Головними й незалежними чинниками ризику раптової серцевої смерті при хронічній серцевій недостатності є виражена дисфункція міокарда (фракція викиду лівого шлуночка менше ніж 45%) і складні шлуночкові аритмії, у тому числі безсимптомні.
Дисфункція шлуночків, що трапляється при хронічній серцевій недостатності, з порушеннями регіонарного й загального розтягнення міокарда, збільшенням напруження стінки призводить до вкорочення потенціалу дії та ефективного рефрактерного періоду, а також деполяризації мембрани на початку діастоли, що може бути тригером і зумовити позачерговий потенціал дії (феномен механіко-електричного зворотного зв’язку). Гетерогенність напруження стінки в різних ділянках шлуночка за його дисфункції збільшує дисперсію де- і реполяризації міокарда і його аритмічну готовність. Зміні електрофізіологічних властивостей міокарда і їхньої неоднорідності сприяє також ішемія міокарда.
Істотну роль в аритмогенезі відіграють нейрогуморальні чинники, як прямо впливаючи на електрофізіологічні властивості мембрани кардіоміоцитів, так і побічно — за рахунок вторинної гіпокаліємії, збільшення об’єму внутрішньосудинної рідини, пре- і постнавантаження та потреби міокарда в кисні.
На виникнення аритмій істотно впливають препарати, що їх застосовують для лікування серцевої недостатності, унаслідок виділення нирками калію і магнію (салуретики) або підвищення автоматизму й збудливості міокарда шлуночків (інотропні агенти). Є дані про збільшення частоти й тяжкості шлуночкових аритмій на тлі лікування р-агоністами, інгібіторами фосфодіестерази, похідними дигідропіридину тощо.
Для виникнення передсердних аритмій, серед яких найпоширеніша фібриляція передсердь, важливе значення мають також дилатація порожнини серця, гіпоксія та ацидоз.
Ускладнення внаслідок ураження печінки при хронічній серцевій недостатності розвиваються часто. Механізмами, що призводять до ураження печінки, є:
1. Венозний застій у печінці. Зростання венозного тиску призводить до атрофії гепатоцитів. Застійні зміни в синусоїдах унаслідок передавання венозного тиску з печінкових венул спричинюють перисинусоїдальний набряк, що порушує оксигенацію й надходження поживних речовин у гепатоцити. Згодом розвиваються фіброзні зміни, які неоднаково виражені в різних ділянках печінки.
2. Гіпоксія клітин печінки, що зумовлена зниженим серцевим викидом, з компенсаторною підвищеною екскрецією кисню в ацинусах.
3. Артеріальна гіпоксемія, значення якої в ураженні печінки при хронічній серцевій недостатності, імовірно, менше, ніж при хронічній обструктивній хворобі легень.
Ураження печінки при хронічній серцевій недостатності пов’язують з активізацією печінкових макрофагів (клітин Купффера), які у відповідь на ішемію продукують прозапальні цитокіни, зокрема чинник некрозу пухлин а, що індукує ушкодження печінки посиленням експресії клітинних молекул адгезії та хемокінів. Це призводить до міграції та активізації поліморфно-ядерних лейкоцитів з виділенням протеаз, які ушкоджують гепатоцити.
Ураження печінки при хронічній серцевій недостатності може проявлятися застійною гепатопатією, ішемічним гепатитом та кардіальним фіброзом і цирозом печінки.
Застійна гепатопатія розвивається переважно через венозний застій унаслідок зниження серцевого викиду. Клінічно проявляється гепато(сплено)мегалією, асцит спостерігається у 25% таких пацієнтів. Характерне помірне підвищення активності АсАТ й АлАТ (триразове), помірна гіпербіліру- бінемія та гіпоальбумінемія.
Ішемічний гепатит, уперше описаний у 1979 р. як ураження печінки, подібне до вірусного гепатиту, в разі швидкого прогресування знижує параметри насосної функції лівого шлуночка (інфаркт міокарда, аритмії, тромбоемболії гілок легеневої артерії). Клінічно ішемічний гепатит проявляється симптомами правошлуночкової недостатності в поєднанні з диспепсичним синдромом (нудотою, блюванням, анорексією), болем у надчеревній ділянці, енцефалопатією. Характерні ознаки вираженого цитолізу (підвищення активності трансаміназ більше ніж у 10 разів), функціональні порушення печінки (підвищення рівня білірубіну, азоту сечовини, подовження протромбінового часу й збільшення МНВ), функціонального стану нирок (підвищення вмісту креатиніну в крові, гіперкаліємія, зниження натрію в сечі за нормального сечового осаду). Діагноз ішемічного гепатиту встановлюють на підставі розвитку’минущої високої гіперферментемії, подовження протромбінового часу й порушення функції нирок в осіб з низькою фракцією викиду лівого шлуночка.
Для ішемічного гепатиту характерний доброякісний перебіг, хоча внут- рішньолікарняна смертність становить 50%. Прогноз визначається не ступенем печінкової дисфункції, а тяжкістю основного захворювання. Якщо стан гемодинаміки стабілізується, то печінкові ферменти нормалізуються через 1—2 тиж, білірубін — трохи пізніше.
Кардіальний фіброз і цироз печінки є пізніми стадіями застійних змін у печінці. Морфологічні зміни варіабельні: від мінімальних депозитів колагену в синусоїдах до широких септ і формування цирозу. Фіброзні септи поширюються вглиб часточки радіально від центральної вени, можуть з’єднуватися з іншими центральними венами, що призводить до характерної для кардіального цирозу картини "зворотної часточкової будови". Вираженість фіброзу в печінці й тяжкість цирозу не корелюють із функціональним класом хронічної серцевої недостатності і тривалістю епізодів декомпенсації. Симптоми кардіального цирозу зазвичай замасковані клінічними проявами правошлуночкової недостатності.
У більшості хворих з кардіальним цирозом печінкові показники в нормі або тотожні з такими при застійній гепатопатії. Попри те, що у значної кількості пацієнтів виявляють розширені вени стравоходу, кровотечі бувають украй рідко. Вираженість асциту може не відповідати ступеню периферійних набряків і клінічних проявів хронічної серцевої недостатності, для асцитичної рідини характерний вищий рівень ЛДГ порівняно з випотом при вірусних і алкогольних цирозах печінки.
Наявність ураження печінки у хворого із хронічною серцевою недостатністю найчастіше не погіршує прогнозу, тому не потребує застосування специфічного лікування. Однак антикоагулянти таким хворим варто призначати обережно у зв’язку з підвищеним ризиком кровотечі.
Ускладнення внаслідок стазу крові. При атеросклерозі, що є підґрунтям більшості захворювань, які призводять до хронічної серцевої недостатності, створюються умови для виникнення тромботичного процесу в різних судинних басейнах. З іншого боку, приєднання хронічної серцевої недостатності до основного захворювання також посилює порушення згортальної системи крові. За даними фундаментальних досліджень А.І. Грицюка, для хронічної серцевої недостатності характерне прогресивне посилення патогенетичних чинників тромбоутворення (уповільнення кровотоку, глибші зміни судинної стінки) на тлі помірних порушень гемокоагуляції в бік гіперкоагуляції крові (однак можлива й невелика гіпокоагуляція), але за умов пригнічення фібринолізу. Такі порушення посилюють небезпеку внутрішньосудинного тромбозу, особливо за наявності відповідних чинників (ліжковий режим, порушення серцевого ритму, варикозне розширення вен нижніх кінцівок тощо). Тромби, що утворюються у венах нижніх кінцівок і розширених порожнинах серця, є вогнищами емболій та інфаркту легені і внутрішніх органів.
Серцева кахексія. Втрата маси тіла, іноді значна, спостерігається у хворих із задавненою серцевою недостатністю і зумовлена:
а) анорексією внаслідок венозного застою в печінці та інших органах травлення;
б) порушенням усмоктування жирів;
в) підвищенням обміну речовин унаслідок значного збільшення роботи дихальних м’язів.
Лікування
Лікування
Метою лікування хворих із серцевою недостатністю є (ЄТК, 2005; УАК, 2006):
1. Профілактика — первинна мета:
— профілактика і/або лікування захворювань, які можуть призвести до дисфункції лівого шлуночка і хронічної серцевої недостатності;
— профілактика розвитку хронічної серцевої недостатності в разі виявлення серцевої дисфункції.
2. Підтримання і поліпшення якості життя.
3. Поліпшення виживання.
Профілактика хронічної серцевої недостатності. Розвиток дисфункції шлуночків серця та хронічної серцевої недостатності можна загальмувати, лікуючи стани, які можуть до них призвести, передусім артеріальну гіпертензію і/або ІХС. За наявності дисфункції міокарда, якщо це можливо, первинною метою є ліквідація причин, які до неї призвели (ішемія, токсичні агенти, алкоголь, лікарські препарати, захворювання щитоподібної залози). Якщо ці причини неможливо ліквідувати, лікування повинно спрямовуватися на вповільнення або профілактику розвитку дисфункції лівого шлуночка, що підвищує ризик раптової смерті й розвиток хронічної серцевої недостатності.
Загальні заходи у лікуванні хронічної серцевої недостатності включають:
1. Лікування основного захворювання й корекцію чинників ризику:
— вторинну профілактику ІХС і розв’язання питання про реваскуляри- зацію міокарда;
— нормалізацію і контроль підвищеного AT;
— хірургічну корекцію вад серця;
— дієтичну й медикаментозну корекцію гіпер(дис)ліпопротеїдемій;
— корекцію гіперглікемії при цукровому діабеті;
— фармакологічну або хірургічну корекцію тахіаритмій (брадиаритмій);
— відмова від тютюнопаління та вживання алкоголю;
— зниження маси тіла при ожирінні.
2. Обмеження добового споживання кухонної солі: менше ніж 3 г на добу при серцевій недостатності I—II ФК, менше ніж 1,5 г на добу при серцевій недостатності III—IV ФК.
3. Регулярна фізична активність: "комфортний", але регулярний руховий режим.
4. Обмеження кількості вживання рідини при симптомах її затримання до 1 — 1,5 л.
У Європейських рекомендаціях щодо лікування хворих із хронічною серцевою недостатністю виділені препарати, яких варто уникати (або призначати обережно) хворим із хронічною серцевою недостатністю:
1) нестероїдні протизапальні препарати й коксиби;
2) антиаритмічні препарати 1-го класу;
3) антагоністи кальцієвих каналів (дилтіазем, верапаміл і похідні дигід- ропіридонів короткої дії);
4) трицикличні антидепресанти;
5) глюкокортикостероїди;
6) препарати літію.
Медикаментозне лікування хронічної серцевої недостатності має проводитися все життя і передбачає використання препаратів з доведеною ефективністю щодо зменшення симптомів і/або підвищення виживання й безпеки. До цих препаратів належать:
1. Інгібітори АПФ, які слід призначати всім хворим із хронічною серцевою недостатністю, незалежно від етіології, стадії процесу й наявності або відсутності декомпенсації серцевої діяльності. У разі непереносимості замість них призначають блокатори рецепторів ангіотензину II. Численні дослідження з плацебо-контролем довели позитивний вплив обох груп препаратів на виживаність хворих із хронічною серцевою недостатністю і систолічною дисфункцією.
2. (З-Адреноблокатори, які на додаток до терапії інгібіторами АПФ також слід призначати всім хворим із ХСН, які не мають протипоказань до такого лікування. Як і інгібітори АПФ, вони впливають на виживаність хворих із систолічною дисфункцією, а також, можливо, і з діастолічною серцевою недостатністю;
3. Діуретики, які показані хворим із затриманням натрію і води в організмі, їхній вплив на виживаність не вивчався.
4. Дигоксин у малих дозах і з обережністю хворим із синусовим ритмом. Включення його до лікування хворих із хронічною серцевою недостатністю додатково до інгібіторів АПФ і діуретиків не впливає на виживаність, але знижує частоту госпіталізацій у зв’язку з декомпенсацією серцевої недостатності.
5. Антагоніст рецепторів до альдостерону (альдактон). У разі призначення в малих дозах разом з інгібіторами АПФ хворим із хронічною серцевою недостатністю високих функціональних класів з систолічною дисфункцією лівого шлуночка поліпшує виживаність.
Інгібітори АПФ належать до препаратів першої лінії в лікуванні хворих із хронічною серцевою недостатністю. їхнє застосування сприяє зменшенню числа госпіталізацій і ризику смерті хворих із систолічною дисфункцією лівого шлуночка (як безсимптомною, так і з хронічною серцевою недостатністю) на 20—25%. У Європейських рекомендаціях щодо лікування хворих із хронічною серцевою недостатністю (2001) було зазначено, що непризначення інгібіторів АПФ хворим із систолічною дисфункцією лівого шлуночка не може вважатися виправданим у жодному разі й призводить до свідомого підвищення ризику смерті хворих. У Європейських рекомендаціях 2005 р. для лікування хворих із хронічною серцевою недостатністю рекомендовано застосовувати тільки 5 препаратів цієї групи, ефективність і безпеку яких доведено у великих багатоцентрових дослідженнях.
Інгібітори АПФ впливають на баланс нейрогормонів, зменшуючи утворення ангіотензину II і, як наслідок, катехоламінів й ендотеліну, збільшуючи вміст брадикініну завдяки блокаді його розпаду.
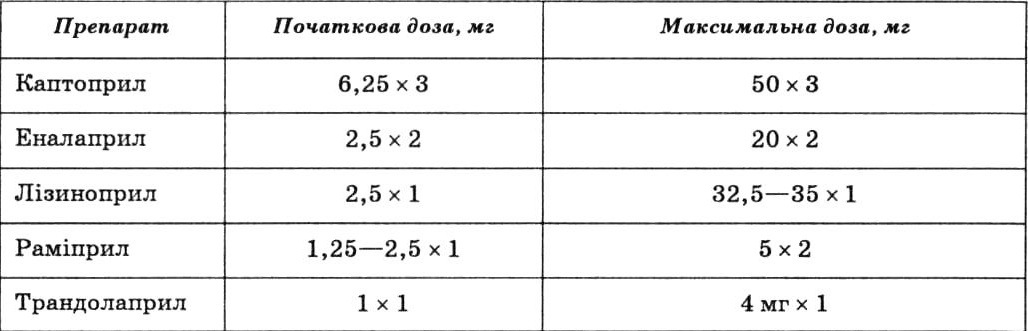
Терапію інгібіторами АПФ варто починати з малих доз, поступово підвищуючи їх (титруючи) до максимальних і, бажано, цільових, ефективність яких щодо виживання доведена в багатоцентрових дослідженнях (табл. 29).
Інгібітори АПФ, які найчастіше застосовують в Україні для лікування хворих із хронічною серцевою недостатністю (дози, частота вживання)
Можливими побічними ефектами інгібіторів АПФ є виражена артеріальна гіпотензія, гіперкаліємія, підвищення рівня креатиніну (часто минуща) і сухий кашель в 1—3% випадків через підвищення вмісту брадикініну, що не супроводжується морфологічними змінами в легенях. Протипоказані препарати при двобічному стенозі ниркових артерій і ангіоневротичному набряку.
Контроль за лікуванням (вимірювання AT, контроль за функціональним станом нирок і вмістом електролітів у крові) варто проводити через 1—2 тиж після кожного підвищення дози.
$-Адреноблокатори тривалий час вважали протипоказаними у лікуванні хворих із хронічною серцевою недостатністю, що пов’язували з їхньою негативною інотропною дією. Однак до середини 1990-х років було доведено ефективність і безпеку трьох препаратів цієї групи: карведилолу, бісопроло- лу й метопрололу-сукцинату тривалої дії (CR), які в багатоцентрових дослідженнях довели здатність знижувати ризик смерті хворих із хронічною серцевою недостатністю і систолічною дисфункцією лівого шлуночка на 34— 35%. Даних щодо ефективності при хронічній серцевій недостатності інших 3-адреноблокаторів, у тому числі атенололу й метопрололу короткої дії (IR), немає. У 2005 р. перелік рекомендованих для лікування хронічної серцевої недостатності Р-адреноблокаторів був доповнений ще одним препаратом — небівололом, який, за даними контрольованого дослідження, впливає на прогноз пацієнтів із хронічною серцевою недостатністю віком понад 70 років.
Доведено двофазність впливу Р-адреноблокаторів на міокард хворих із хронічною серцевою недостатністю:
1) зниження фракції викиду в перші 2 тиж лікування;
2) наступне збільшення фракції викиду й толерантності до фізичного навантаження за даними велоергометри і тредміл-тесту, що пов’язано зі зменшенням тахікардії, споживання міокардом кисню та відновленням скоротливості кардіоміоцитів, які перебували в стані оборотної ішемічної дисфункції.
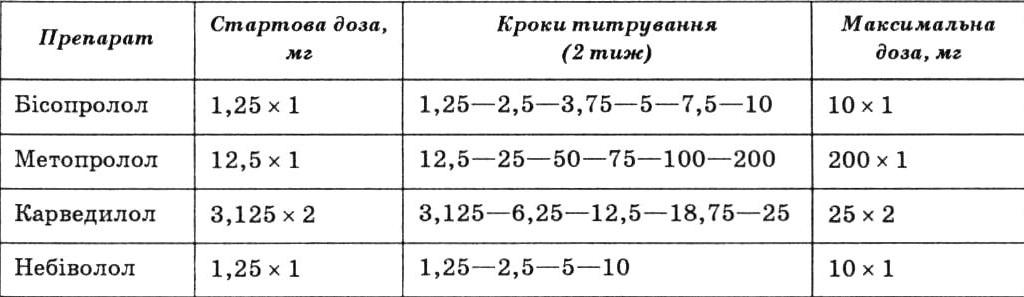
Р-Адреноблокатори слід призначати всім хворим із хронічною серцевою недостатністю, що не мають протипоказань, додатково до терапії інгібіторами АПФ після стабілізації стану. Лікування починають зі стартової дози (зазвичай 1/8 терапевтичної), дозу збільшують через 2 тиж і навіть рідше, до досягнення цільової терапевтичної (табл. 30).
Р-Адреноблокатори, які застосовують для лікування хворих із хронічною серцевою недостатністю (дози, частота вживання)
Р-Адреноблокатори протипоказані хворим із бронхіальною астмою, ЧСС менше ніж 55 за 1 хв, систолічному AT 85 мм рт. ст. і нижче, атріовентри- кулярних блокадах високого ступеня (якщо не імплантовано штучний водій ритму), тяжких облітераційних захворюваннях артерій нижніх кінцівок із симптомами ішемії в стані спокою.
Під час проведення терапії р-адреноблокаторами необхідний контроль за рівнем AT й ЧСС, симптомами хронічної серцевої недостатності, ознаками затримання рідини. У разі наростання симптомів хронічної серцевої недостатності передусім варто збільшити дозу діуретиків й інгібіторів АПФ, і тільки за неефективності такої тактики — тимчасово знизити дозу р-адреноблокатора. При розвитку артеріальної гіпотензії, насамперед симптоматичної, рекомендовано зменшити дозу вазодилататора, і тільки якщо це не дає ефекту — тимчасово знизити дозу Р-адреноблокатора. При розвитку брадикардії (ЧСС менше ніж 55 за 1 хв) потрібно тимчасово зменшити дозу р-адреноблокатора.
Діуретини призначають хворим із хронічною серцевою недостатністю, в яких є ознаки затримання рідини в організмі (набряки, задишка із застійними хрипами в легенях, збільшення маси тіла). Препарати цієї групи істотно зменшують симптоми хронічної серцевої недостатності, але не сповільнюють її прогресування і не поліпшують прогнозу, що пов’язано з їхньою здатністю активізувати ренін-ангіотензинову й симпатико-адреналову системи у відповідь на зниження об’єму циркулюючої плазми крові. Тому їх рекомендують призначати тільки разом із препаратами, що знижують нейрогуморальну активізацію, — інгібіторами АПФ і/або Р-адреноблокаторами.
При хронічній серцевій недостатності перевагу варто надавати петльо- вим діуретикам (фуросемід, торасемід, етакринова кислота), хоча хворим з помірними порушеннями гемодинаміки Європейське товариство кардіологів пропонує сечогінну терапію починати із застосування більш слабких препаратів — тіазидних діуретиків. Калійзберігальні діуретики (тріамтерен, амілорид і спіронолактон) використовують тільки за наявності гіпокаліємії після призначення інгібіторів АПФ і діуретиків.
Лікування зазвичай починають із малих доз, надалі підбираючи дозу для досягнення бажаного ефекту: гідрохлоротіазиду 25 мг (максимально 100 мг), фуросеміду 20—40 мг (максимально до 500 мг), торасеміду 10—20 мг (максимально до 100 мг) на добу. Препарати зазвичай призначають ранком натще.
Хворим із рефрактерними набряками рекомендовано:
1. Застосування петльових діуретиків у поєднанні з тіазидними й калій- зберігальними (краще спіронолактон) для так званої послідовної блокади реабсорбції натрію у нефроні. Поєднання двох петльових діуретиків не посилює ефекту і тому недоцільне.
2. Внутрішньовенне введення петльових діуретиків, зазвичай струминне.
3. За наявності гіпопротеїнемії (гіпоальбумінемії) її коригують внутрішньовенною інфузією альбуміну.
4. Тривале (упродовж кількох діб) внутрішньовенне введення допаміну в діуретичних дозах (1—5 мкг ? кг-1 • хв-1).
5. Ізольована ультрафільтрація крові (якщо збережений серцевий викид і відсутні артеріальна гіпертензія і стенози клапанів).
При гідротораксі й асциті, резистентних до медикаментозної терапії, показана евакуація рідини.
Оцінювання ефективності й корекцію дози діуретиків проводять на підставі регулярного визначення маси тіла (у період активної діуретичної терапії — щодня, у підтримувальний період — 1—2 рази на тиждень).
Серцеві глікозиди. Єдиним серцевим глікозидом, ефективність і безпека якого доведена, є дигоксин. Саме цей препарат рекомендований для лікування хворих із хронічною серцевою недостатністю і систолічною дисфункцією лівого шлуночка. Результати плацебо-контрольованих багатоцентрових досліджень засвідчують, що тривале вживання дигоксину в поєднанні з інгібіторами АПФ і діуретиком істотно не впливають на показники виживання хворих із хронічною серцевою недостатністю, однак знижують частоту декомпенсації і випадків госпіталізації.
При синусовому ритмі дигоксин застосовують у малих дозах (0,25— 0,375 мг), які сприяють зниженню активності симпатико-адреналової системи, без попередньої дигіталізації. Вищі дози справляють негативний вплив на прогноз хворих із хронічною серцевою недостатністю. У хворих з нирковою недостатністю та осіб літнього віку доза препарату повинна бути зменшена до 0,0625—0,125 мг. При вираженій хронічній нирковій недостатності можлива заміна дигоксину на дигітоксин, який виводиться переважно з жовчю.
При фібриляції передсердь дигоксин є засобом першої лінії завдяки його здатності сповільнювати атріовентрикулярне проведення і знижувати ЧСС. За наявності синусового ритму цей препарат показаний хворим із систолічною дисфункцією лівого шлуночка в разі недостатньої ефективності інгібіторів АПФ, (і-адреноблокаторів і діуретиків при частих декомпенсаціях серцево-судинної діяльності й госпіталізаціях.
Антагоністи альдостерону (спіронолактон, еплеренон). Останнім часом описаний феномен "вислизання" ренін-ангіотензинової системи з-під контролю інгібіторами АПФ або антагоністами рецепторів ангіотензину II, що полягає у відновленні підвищеного рівня альдостерону на тлі вживання цих препаратів. Повна тривала (так звана тверда) блокада ренін-ангіотензин-аль- достеронової системи можлива лише в разі поєднання інгібіторів АПФ або антагоністів рецепторів ангіотензину II з антагоністами альдостерону. Установлено також самостійну антипроліферативну й антиапоптичну дію антагоністів альдостерону.
Доведено, що комбінація інгібіторів АПФ з малими дозами спіронолак- тону (25—50 мг на добу) вірогідно знижує загальну смертність (на 7%), смертність унаслідок прогресування хронічної серцевої недостатності (на 28%), раптову смерть (на 26%) і кількість госпіталізацій у зв’язку з декомпенсацією хронічної серцевої недостатності (на 30%).
Можливими побічними ефектами спіронолактону є гіперкаліємія, наростання рівня креатиніну, а також розвиток гінекомастії (у 10% випадків), порушення менструального циклу (у 2% випадків), що пов’язують із неселективністю дії препарату на рецептори альдостерону. Хоча доведено, що поєднане застосування малих доз спіронолактону (25 мг на добу) з інгібіторами АПФ практично не спричинює збільшення рівня калію в плазмі крові, цей показник все-таки варто контролювати під час лікування.
Рекомендації з призначення цих препаратів у хворих із хронічною серцевою недостатністю включають (ЄТК, 2005):
1. Тяжку хронічну серцеву недостатність, попри терапію інгібіторами АПФ і діуретиками.
2. Рівень калію в сироватці крові менше ніж 5 ммоль/л і креатиніну менше ніж 250 ммоль/л.
3. Застосовувати малі дози (спіронолактону 25 мг, еплеренону 25 мг).
4. Перевіряти рівень калію і креатиніну через 4—6 днів.
5. Припинити вживання, коли рівень калію становитиме понад 5,5 ммоль/л.
6. Якщо симптоми серцевої недостатності тривають протягом 1 міс і рівень калію в нормі, слід збільшити дозу до 50 мг на добу й повторно визначити рівень калію і креатиніну через 1 тиж.
Додаткові засоби в лікуванні хронічної серцевої недостатності. До них належать антагоністи рецепторів ангіотензину II, периферійні вазодилататори, аміодарон, неглікозидні інотропні засоби, непрямі антикоагулянти й анти- тромботичні засоби.
Антагоністи рецепторів до ангіотензину II першого типу рекомендовані для лікування хворих із хронічною серцевою недостатністю у разі непере- носимості інгібіторів АПФ. Прямі й непрямі порівняльні дослідження показали однакову клінічну ефективність блокаторів рецепторів ангіотензину II і інгібіторів АПФ щодо підвищення виживання й зниження частоти декомпенсації серцево-судинної діяльності у хворих із хронічною серцевою недостатністю і систолічною дисфункцією в разі використання їх цільових доз. На сьогодні рекомендовані до застосування тільки два препарати цієї групи — вальсартан (80—160 мг на добу) і кандесартану цилексетил (32 мг на добу).
Позитивний вплив периферійних вазодилататорів крім амлодипіну і фе- лодипіну на прогноз, кількість госпіталізацій і прогресування хронічної серцевої недостатності не доведений. При цьому насторожує їхня здатність спричинювати більш-менш виражену рефлекторну активізацію симпатико-адреналової системи у відповідь на вазодилатацію, що потенційно може негативно позначитися на прогнозі. Препаратами цієї групи, безпечність призначення яких у доповнення до препаратів першої лінії доведено в багатоцентрових дослідженнях, є амлодипін і фелодипін. Застосовувати препарати цієї групи варто лише за наявності прямих показань (стенокардія, артеріальна гіпертензія). Слід враховувати, що використання периферійних вазодилататорів може погіршити переносимість препаратів першої лінії (інгібіторів АПФ і Р-адреноблокаторів) через їхню здатність знижувати AT.
Блокатори кальцієвих каналів, що сповільнюють ЧСС (верапаміл і дилтіазем) можуть використовуватися у хворих з початковою хронічною серцевою недостатністю внаслідок діастолічної дисфункції лівого шлуночка, однак їхню здатність впливати на перебіг і наслідки хронічної серцевої недостатності у таких випадках не встановлено. У хворих із систолічною дисфункцією лівого шлуночка їхнє призначення погіршує клінічний перебіг хронічної серцевої недостатності. Дигідропіридини короткої дії при хронічній серцевій недостатності протипоказані.
Антиаритмічна терапія й профілактика раптової смерті. При хронічній серцевій недостатності лікування потребують лише небезпечні для життя і симптоматичні шлуночкові порушення ритму серця. Препаратами вибору в цьому разі є Р-адреноблокатори, а в разі їхньої неефективності — аміодарон у малих підтримувальних дозах (100—200 мг на добу) або комбінація цих препаратів. їхнє застосування знижує ризик раптової серцевої смерті хворих на хронічну серцеву недостатність, навіть за відсутності симптоматичних шлуночкових аритмій. Усі інші антиаритмічні препарати у хворих на хронічну серцеву недостатність протипоказані через доведену здатність знижувати виживаність як наслідок проаритмічного ефекту. У хворих, які перенесли симптоматичну шлуночкову тахікардію або раптову зупинку кровообігу, єдиним ефективним методом лікування, що забезпечує підвищення виживання, є профілактична імплантація автоматичного кардіовертера-дефібрилятора. Зазвичай одночасно призначають підтримувальну дозу аміодарону.
Переконливих даних щодо доцільності застосування антиагрегантів для лікування хворих із хронічною серцевою недостатністю немає. Для запобігання тромбозу в периферійних венах і тромбоемболії гілок легеневої артерії у хворих із хронічною серцевою недостатністю і вираженим венозним застоєм, особливо тих, хто перебуває на ліжковому режимі, ефективним є лікування профілактичними дозами НМГ (еноксапарину 1 мг/кг), а за наявності хронічного тромбофлебіту і/або перенесеного епізоду тромбоемболії гілок легеневої артерії — постійне вживання непрямих антикоагулянтів під контролем МНВ 2—3 од. Для профілактики тромбоутворення в передсердях і тромбоемболій у хворих із хронічною серцевою недостатністю і постійною формою фібриляції передсердь, особливо при тромбоемболіях в анамнезі й мітральному стенозі, показані непрямі антикоагулянти (МНВ 2—3 од). Призначення ацетилсаліцилової кислоти пацієнтам з частими госпіталізаціями з приводу хронічної серцевої недостатності варто уникати через ризик збільшення симптомів цього синдрому.
Тривале застосування неглікозидних інотропних препаратів (Р-адрено- стимуляторів та інгібіторів фосфодіестерази) підвищує ризик смерті хворих із хронічною серцевою недостатністю, імовірно, внаслідок нейрогуморальної активізації. Тому ці препарати застосовують винятково для короткочасного (протягом 2—5 діб) інотропного підтримування в період декомпенсації (добутаміну 2—5 мкг • кг"1 ? хв"1).
Лікування хворих зі збереженою фракцією викиду лівого шлуночка (діасто- лічною дисфункцією) повинно включати перелічені вище інгібітори АПФ і P-адреноблокатори. Діуретики слід призначати обережно через імовірність надмірного зменшення переднавантаження. У Європейських рекомендаціях 2005 р. для лікування цієї категорії хворих запропоновано використовувати антагоніст рецепторів ангіотензину II кандесартан (32 мг на добу).
Хірургічні методи поліпшення насосної функції серця
Хірургічна реваскуляризація міокарда у хворих з ІХС і хронічною серцевою недостатністю дає змогу підвищити фракцію викиду лівого шлуночка в середньому на 19% і зменшити його діаметр на 14%. Метод зазвичай ефективний за наявності життєздатного міокарда. Міокард хворих із хронічною серцевою недостатністю в умовах гіпоперфузії часто містить "сплячі", або гібернувальні, кардіоміоцити, скоротливість яких знижена, тому вони споживають мінімум кисню. Успішна реваскуляризація може повністю відновити їхню скоротливість. Однак у хворих з великими вогнищами дифузного або вогнищевого кардіосклерозу таке лікування може виявитися неефективним. Консультація кардіохірурга для вирішення питання про доцільність реваскуляризації міокарда показана всім хворим із хронічною серцевою недостатністю ішемічного генезу.
Трансплантація серця вперше була здійснена в 1967 р. К. Барнардом. Нині у США проводять понад 2,5 тисячі таких операцій за рік. Середня тривалість життя хворих, які перенесли операцію трансплантації серця, становить 9,1 року, що значно перевищує результати медикаментозного лікування. Широке впровадження такої терапії істотно обмежують проблеми донорства, висока вартість і побічні ефекти супровідної імуносупресивної терапії, необхідність частих повторних ендоміокардіальних біопсій, хвороба вінцевих судин пересадженого серця. Останнім часом обговорюється недоцільність масового застосування трансплантації серця і перспективність цього методу розглядається як сумнівна.
Перспективні хірургічні методи лікування хронічної серцевої недостатності. Одним з найбільш вивчених і перспективних методів хірургічного лікування хворих із хронічною серцевою недостатністю є метод допоміжного кровообігу, або "штучний лівий шлуночок ". Метод має доведену ефективність, що дало підставу Товариству кардіологів Росії рекомендувати тривалу (на кілька місяців) імплантацію штучного лівого шлуночка як альтернативу трансплантації серця для лікування хворих із критичними порушеннями гемодинаміки внаслідок хронічної серцевої недостатності. Результати контрольованого дослідження з імплантації штучного лівого шлуночка засвідчують, що таке лікування сприяє зниженню ризику смерті хворих із хронічною серцевою недостатністю на 48% протягом 2 років.
Ефективність хірургічного обмеження ремоделювання лівого шлуночка через видалення частини стінки для зменшення розмірів порожнини й зниження міокардіального стресу (операції Батиста й аневризмектомії). Ці методи не мають самостійного значення у лікуванні хронічної серцевої недостатності і можуть розглядатися як "містки" до трансплантації серця.
Електрофізіологічні методи лікування хворих із хронічною серцевою недостатністю включають імплантацію кардіостимуляторів з адаптованою до фізичного навантаження частотою стимуляції й кардіовертерів-дефібриляторів хворим із хронічною серцевою недостатністю і небезпечними для життя порушеннями ритму серця і провідності. Європейськими рекомендаціями 2005 р. запропоновано використовувати цей метод для поліпшення прогнозу хворих на постінфарктний кардіосклероз з високим ризиком раптової смерті (зниження до 35% фракції викиду лівого шлуночка через 40 днів від моменту розвитку інфаркту міокарда).
Перспективним методом є ресинхронізація скорочення серця за допомогою трикамерної стимуляції його (з обох шлуночків і правого передсердя). Метод дає змогу усунути асинхронію в скороченні шлуночків та передсердь і встановити оптимальну для кожного хворого атріовентрикулярну затримку (час між скороченнями передсердь і шлуночків), що забезпечує оптимальне діастолічне наповнення і серцевий викид. Ресинхронізація роботи серця дає змогу досягати клінічного поліпшення, сповільнювати ремоделювання серця й підвищувати якість життя. Показана пацієнтам із шлуночковою десинхронією (тривалістю понад 120 мс) і тяжкою хронічною серцевою недостатністю, резистентною попри оптимальну медикаментозну терапію.
У Європейських рекомендаціях 2005 р. для лікування хворих з тяжкою хронічною серцевою недостатністю (вище ніж III функціональний клас за NYHA і фракцією викиду лівого шлуночка менше ніж 35%) рекомендована також комбінація кардіовертерів-дефібриляторів і бівентрикулярної електрокардіостимуляції.
Подальша інформація
Завжди консультуйтеся зі своїм лікарем, щоб переконатися, що інформація, яка відображається на цій сторінці, може бути застосована до ваших особистих обставин. Інформація призначена тільки для медичних фахівців.