Гостра лейкемія (лейкоз)
Патологічна анатомія
Гостра лейкемія — злоякісна пухлина кровотвірної тканини, що походить із кісткового мозку. Її морфологічним субстратом є лейкемічні бластні клітини, що відповідають родоначальним елементам одного з ростків кровотворення.
Гострі лейкемії посідають провідне місце в структурі захворюваності на гемобластози і становлять приблизно 1/3 їх загального числа. Середньорічний показник захворюваності в Європі становить 3—5 на 100 000 населення. Етіологічні фактори, що зумовлюють розвиток гемобластозів, так само здатні викликати і гострі лейкемії.
Розвиток гострої лейкемії являє собою низку процесів, починаючи зі специфічної мутації і виникнення пухлинної клітини, здатної до безмежної моноклональної проліферації, яка втратила здатність реагувати на фактори, що зумовлюють її диференціацію. Унаслідок цього в кістковому мозку накопичується маса лейкемічних бластних клітин, які продукують гуморальні інгібітори нормального гемопоезу і фізично витісняють нормальні клітини кровотвірної тканини. Це призводить до зниження продукування еритроцитів, гранулоцитів, тромбоцитів з розвитком відповідних клінічних проявів цитопенії.
Циркуляція лейкемічних клітин у крові супроводжується появою вогнищ пухлинного росту (метаплазії) у різних органах і тканинах.
Патологічна анатомія. Макроскопічні зміни при гострій лейкемії значно варіюють. У більшості хворих визначають гіперплазію кісткового мозку в плоских кістках, заміщення жирового кісткового мозку на червоний у трубчастих кістах, хоча в деяких випадках не знаходять гіперплазії або, більше того, виявляють гіпоплазію кісткового мозку. Лімфатичні вузли і селезінка можуть бути не збільшені, а якщо визначається їхнє збільшення, то воно зазвичай нерізко виражене: на розрізі вони темно-червоні, червоні або сіро- рожеві, м’які. Печінка збільшена помірно, в’яла, на розрізі часто помітні лейкемічні інфільтрати. Такі ж інфільтрати виявляють у підшлунковій залозі. Порожнина перикарда нерідко містить рідину, іноді геморагічного характеру, можливі крововиливи під епікард, в ендокард і міокард, виявляють макроскопічно видимі лейкемічні інфільтрати. Порожнина плеври також часто містить серозну або кров’янисту рідину, у легенях можна помітити лейкемічні інфільтрати різної величини, часто виявляють пневмонію.
Зміни спостерігають і в кишках, у нирках, вони характеризуються появою крововиливів і лейкемічних інфільтратів.
У головному та спинному мозку відзначають геморагії різної величини, лейкемічні інфільтрати в тканині мозку, твердій мозковій оболоні.
В основу сучасної класифікації гострих лейкемій покладено цитологічні й цитохімічні характеристики лейкемічних клітин, що свідчать про особливості їх метаболізму. Назви форм гострої лейкемії походять від назв нормальних попередників пухлинних клітин: мієлобласти, лімфобласти, еритробласти тощо. Гостра лейкемія з морфологічно неідентифікованими бласт- ними клітинами одержала назву недиференційованої. Ідентифікацію морфологічних варіантів гострої лейкемії провадять на підставі даних цито- хімічного дослідження пунктатів кісткового мозку або мазків периферійної крові (за наявності лейкоцитозу і вираженої бластемії).
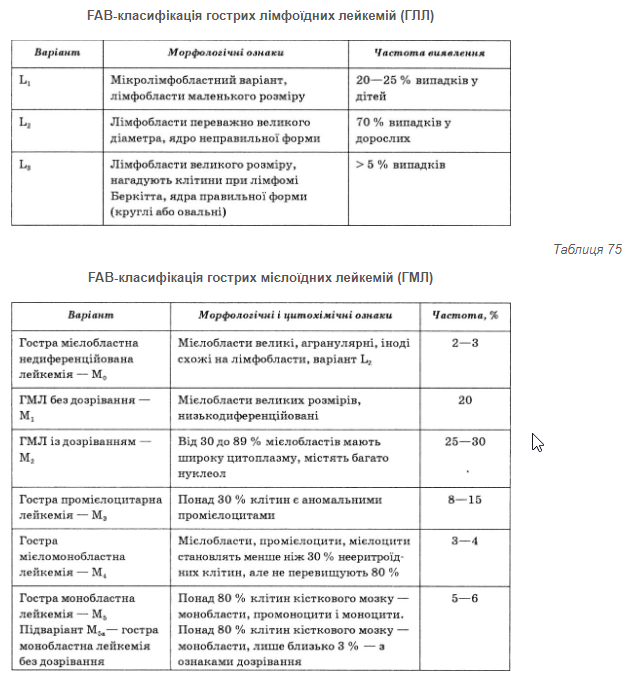
За сучасними уявленнями про поділ кровотворення на мієлоїдне і лімфоїдне всі форми гострих лейкемій поділяють на 2 групи: гострі лімфобластні (лімфоїдні) лейкемії (табл. 74) та гострі нелімфобластні (мієлоїдні) лейкемії (табл. 75).
Таблиця 74
FAB-класифікація гострих лімфоїдних лейкемій (ГЛЛ)
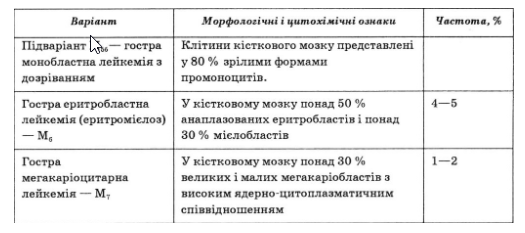
Розрізнюють також окремі форми мієлопоетичних дисплазій або мієло- диспластичний синдром: рефрактерна анемія (РА), рефрактерна анемія з надлишком бластів (РАНБ), рефрактерна анемія з надлишком бластів у стадії трансформації (РАНБ-Т), хронічна мієломоноцитарна лейкемія (ХММЛ).
Таблиця 76
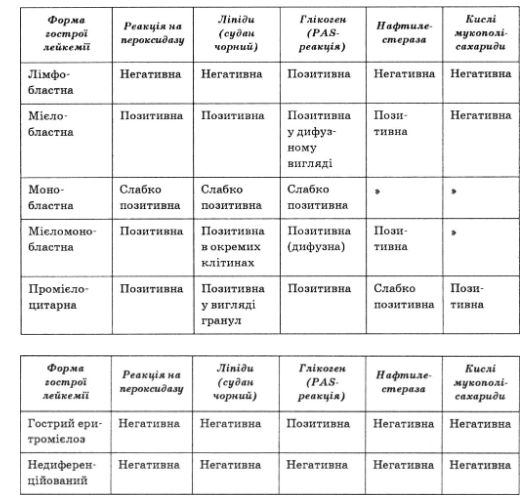
Критерії цитохімічної діагностики окремих форм гострої лейкемії
Клінічна картина
Клінічні прояви гострої лейкемії зумовлені нагромадженням в організмі (кістковому мозку, крові, вогнищах метаплазії в органах і тканинах) злоякісних бластних клітин, пригніченням нормального кровотворення з розвитком анемії, гранулоцитопенії, тромбоцитопенії, інтоксикації.
Початкові прояви захворювання не специфічні і, як правило, не привертають особливої уваги, часто оцінюються лише ретроспективно. У розгорнутій фазі нелікованої гострої лейкемії клінічна картина складається з кількох провідних синдромів:
1) пухлинної інтоксикації;
2) пухлинної проліферації;
3) анемічного;
4) геморагічного;
5) виразково-некротичного;
6) синдрому нейролейкемії.
Інтоксикація може бути виражена помірно, і тоді хворий скаржиться на загальну слабкість, зниження працездатності, відсутність апетиту. При більш вираженій інтоксикації спостерігають підвищення температури тіла до високих значень, головний біль, біль у кістках і м’язах, різку слабкість, апатію. Гарячка може бути зумовлена як власне пухлинним процесом, так і приєднанням бактеріальних інфекцій. Синдром пухлинної проліферації виявляється збільшенням не лише периферійних лімфатичних вузлів, а й селезінки та печінки. У частини хворих спостерігають значне збільшення мигдаликів, яке спричинює утруднення ковтання, дихання, збільшення лімфатичних вузлів середостіння, що перебігає із синдромом здавлення: задишкою, набряклістю шиї і грудної клітки, синюшністю. Прогностично несприятливою ознакою вважають гіперплазію ясен, що супроводжується гнійним гінгівітом, виразково-некротичним стоматитом. Нерідко лейкемічні інфільтрати (лей- кеміди) з’являються на шкірі, вони мають вигляд червонувато-синюшних, дещо здійнятих над поверхнею папул. На відміну від алергійних висипань їх поява не супроводжується свербежем. Лейкемічна гіперплазія кісткового мозку зумовлює прогресування анемії і тромбоцитопенії. У деяких хворих з гострою лейкемією анемічний синдром переважає в клінічній картині і характеризується вираженою блідістю шкіри і слизових оболонок, серцебиттям, задишкою, запамороченнями, шумом у вухах, знепритомненням.
Глибока тромбоцитопенія є основною причиною одного з найтяжчих синдромів гострої лейкемії — геморагічного. Він може проявлятися висипами на шкірі і слизових оболонках — петехіальними, плямистими, крововиливами в кон’юнктиву ока, кровотечами носовими, ясенними, матковими, шлунково-кишковими. Крововиливи в речовину головного мозку, міокард можуть стати причиною смерті хворих. Особливо різко виражений геморагічний синдром у хворих з промієлоцитарною гострою лейкемією.
Виразково-некротичні і гнійні процеси при гострій лейкемії зумовлені насамперед гранулоцитопенією, а також лейкемічною інфільтрацією тканин і локалізуються переважно на слизовій оболонці ротової порожнини, глотки, стравоходу. Часто бувають ангіни, пневмонії і плевропневмонії, панариції, фурункульоз, парапроктити.
Поява лейкемічних інфільтратів в оболонах, судинних сплетеннях, речовині головного і спинного мозку зумовлює найрізноманітнішу симптоматику уражень центральної нервової системи — синдром нейролейкемії. Нейролейкемія проявляється симптомами підвищення внутрішньочерепного тиску і менінгеальним синдромом: нестерпним головним болем, запамороченням, нудотою, блюванням, появою менінгеальних знаків, розладами функції черепних нервів. Рідше розвивається симптоматика внутріш- ньомозкових пухлин, пов’язана з локалізацією пухлини. Можливі ураження периферійних нервів унаслідок лейкемічної інфільтрації нервових стовбурів і корінців.
Перебіг гострої лейкемії неухильно прогресує, а тому хворі без лікування помирають протягом 2—3 міс від появи клінічних ознак захворювання.
У клінічній практиці виділяють стадії гострої лейкемії, що визначають особливості лікувальної тактики. Оскільки дані про початковий період дуже мізерні, І стадією вважають стадію виражених клінічних проявів. Це перший гострий період, що охоплює час від появи перших клінічних симптомів захворювання, установлення діагнозу, початку лікування до отримання ефекту від терапії.
II стадія — ремісія (від лат. remissio — ослаблення). Завдяки успішній цитостатичній терапії різко зменшується маса лейкемічних клітин в організмі, зникають клінічні симптоми захворювання, нормалізується склад периферійної крові і кісткового мозку. Якщо при цьому в кістковому мозку кількість бластних клітин не перевищує 5%, а лімфоцитів — 30%, такий стан розцінюють як повну клініко-гематологічну ремісію.
Неповна ремісія — це такий стан, за якого нормалізуються клінічні показники і гемограма, але в пунктаті кісткового мозку зберігається не більш ніж 20% бластних клітин.
Відсутність ефекту від цитостатичної терапії розцінюють як прогресування захворювання за наявності первинної резистентності до лікування.
Ill стадія — рецидив, зумовлений виходом залишкової лейкемічної популяції з-під контролю підтримувальної і протирецидивної терапії, наростанням бластозу в кістковому мозку та крові, появою клінічних симптомів, характерних для розгорнутої стадії захворювання.
Повні клініко-гематологічні ремісії, що тривають понад 5 років, розцінюють як одужання — це IV стадія процесу.
Термінальна стадія гострої лейкемії є завершальним етапом пухлинної професії, що характеризується повним виснаженням нормального кровотворення, резистентністю до хіміотерапії і безперспективністю терапевтичних зусиль.
Зміни в крові і кістковому мозку. Картина крові в період виражених клінічних проявів у переважної більшості хворих характеризується специфічними змінами. Анемія зазвичай є нормохромною, гіпорегенераторною з тенденцією до поглиблювання. Кількість лейкоцитів частіше знижена, проте надалі може підвищуватися до помірних (сублейкемічних) і високих (лейкемічних) значень. Проте в деяких хворих і в період розпалу захворювання залишається виражена лейкопенія. Під час дослідження мазка крові виявляють бластні клітини, кількість яких може коливатися в широких межах. Кількість зрілих гранулоцитів зменшена, спостерігається лейкемічний провал — відсутність проміжних стадій дозрівання гранулоцитів. Кількість тромбоцитів майже завжди зменшена, іноді до критичних цифр, ШОЕ збільшена.
Така картина крові зумовлена самим лейкемічним процесом і характерна (специфічна) для гострої лейкемії. Однак у процесі лікування захворювання вона істотно змінюється, а при досягненні повної ремісії остаточно нормалізується.
У кістковому мозку при гострій лейкемії виявляють бластну проліферацію різного ступеня вираженості — від помірної до повного заміщення бластними клітинами елементів нормального кровотворення. Розрив між бластними клітинами і зрілими гранулоцитами (лейкемічний провал) виявляють і в кістковому мозку. Нормальне кровотворення редуковано.
Методи діагностики
Дослідження стернального пунктату проводять на пофарбованих мазках кісткового мозку, які розглядають спочатку при малому збільшенні мікроскопа для виявлення комплексів атипових клітин, клітин Березовського—Штернберга, Пирогова—Лангганса, мегакаріоцитів, а потім при великому збільшенні підраховують не менше ніж 500 клітин і обчислюють процентний вміст кожного виду клітин. Крім того, у рідкій частині кісткового мозку визначають сумарну кількість мієлокаріоцитів у 1 мм3, що дає уявлення про клітинність кісткового мозку.
Стернальний пунктат отримують у процесі пункції груднини голкою Кассирського на рівні III—IV ребра по середній лінії з попередньою місцевою анестезією 1—2% розчином новокаїну. Оцінюючи пунктат кісткового мозку, крім кількості окремих видів клітин визначають співвідношення між елементами лейкопоезу та еритропоезу — лейко-еритроїдне відношення. У здорових людей воно становить 3:1 або 4:1. Збільшення кістково-мозкових клітин за рахунок елементів лейкопоезу зі збільшенням лейко-еритроїдного відношення свідчить про гіперплазію мієлоїдних елементів, яка характерна для лейкемії, інфекцій, інтоксикацій. Зниження лейко-еритроїдного відношення до 2:1, 1:1 виявляють у хворих з гіперплазією еритропоезу, що характерно для післягеморагічної, гемолітичної, В12-дефіцитної анемії. Уразі тотального зменшення маси мієлокаріоцитів у кістковому мозку, яке спостерігають при гіпопластичній анемії, лейко-еритроїдне відношення може залишитися в нормі.
Для оцінювання тієї або іншої реакції кісткового мозку (нейтрофільної, еритробластичної) обчислюють співвідношення між молодими і більш зрілими клітинами даного ряду. У нормі відношення власне мієлоцитних перед- стадій до зрілих нейтрофілів, так званий кістково-мозковий індекс нейтрофілів, дорівнює 0,6—0,8; індекс дозрівання еритробластів становить 0,8. Таким чином, вивчення пунктату кісткового мозку конкретизує наші уявлення про характер змін у системі кровотворення, дає змогу визначити наявність системних або реактивних зрушень, переважання певних елементів і ступінь їхнього дозрівання. У кінцевому підсумку поряд з оцінюванням показників периферійної крові це дає змогу остаточно вирішити питання діагностики.
Значення дослідження пунктату кісткового мозку дещо применшено через те, що під час пункції ми отримуємо суміш кістковомозкових клітин і крові у невизначеному співвідношенні, вміст — лише з обмеженого пункцією місця кісткового мозку і, нарешті, отримуємо для дослідження лише масу клітин.
Уявлення про гістологічну структуру кісткового мозку, будову кісткових балок, ретикулярної строми, судин, жирової та мієлоїдної тканин дає трепа- нобіопсія клубової кістки. Трепанат отримують за допомогою голки-троака- ра з гребінця клубової кістки після місцевої анестезії тканин.
Нині трепанобіопсія клубової кістки стала обов’язковим методом діагностики в гематології, оскільки вона дає змогу оцінювати тканинні взаємовідношення в кістковому мозку, виявляти його гіперплазію або гіпоплазію, наявність атипових утворень, метастазів пухлин, вираженість фіброзу та іншу патологію, недоступну для виявлення іншими методами.
Пункція лімфатичного вузла дає змогу зробити цитологічне дослідження клітинного складу збільшеного лімфатичного вузла і в деяких випадках вирішити діагностичні питання. Якщо пунктат отримати не вдається, тоді проводять біопсію лімфатичного вузла для гістологічного дослідження.
Цитохімічні дослідження клітин крові і кісткового мозку дають змогу визначити вміст у них білків, вуглеводів, жирів, металів, вітамінів, а також біологічно активних білків-ферментів. Метаболічні процеси в клітинах крові і кровотвірних органів суворо специфічні для кожного типу клітин, що є основою для їх ідентифікації.
Цитохімічні дослідження бластних клітин при гострому лейкозі і визначення морфологічних варіантів відіграють важливу практичну роль насамперед у виборі адекватної цитостатичної терапії, а також нерідко дозволяють прогнозувати перебіг патологічного процесу.
Завдяки цитогенетичному дослідженню (каріотипуванню) не лише виявляють в хромосомному апараті пацієнта аномалії (транслокацію, делецію та ін.), а й оцінюють ефективність терапії і прогноз захворювання.
Метод флуоресцентної гібридизації in situ (FISH-метод) дає змогу за допомогою флуоресцентних різнозабарвлених зондів виявляти хромосомні аномалії, наявність химерних генів.
Імунофенотипування дає змогу визначати видові й диференціювальні антигени (СД-антигени) на поверхні чи в цитоплазмі пухлинних клітин кісткового мозку або крові за допомогою моноклональних антитіл і, таким чином, вивчити напрям диференціювання, стадію диференціювання клітин, ступінь їхньої зрілості.
Імунологічні дослідження при захворюваннях крові широко застосовують як у повсякденній практиці (дослідження групової належності, резус-фактора), так і спеціально — для виявлення антитіл до клітин крові, резус- фактора, а також під час проведення тканинного типування і підбору донора кісткового мозку.
Діагноз гострої лейкемії встановлюють з урахуванням клінічних даних, однак ґрунтується він на результатах морфологічного дослідження периферійної крові і стернального пунктату. Вирішальним критерієм є наявність у крові та кістковому мозку пухлинних бластних клітин. Кількість їх у крові може бути різна — від одиничних до 90—95%. Діагноз гострої лейкемії вважають підтвердженим за наявності в кістковому мозку 30% і більше бластних клітин, порушення нормальних клітинних співвідношень у мієлограмі, зменшення кількості або відсутності мегакаріоцитів.
У тих випадках, коли під час дослідження стернального пунктату отримують непереконливі дані, слід провести трепанобіопсію клубової кістки і вивчити гістологічні препарати кісткового мозку. За гострої лейкемії виявляють дифузну або великовогнищеву бластну інфільтрацію, порушення співвідношення нормальних ростків кровотворення, пригнічення нормального гемопоезу.
Наступний етап діагностики гострої лейкемії є ідентифікація морфологічного варіанта захворювання. Її здійснюють за допомогою цитохімічних досліджень мазків кісткового мозку (маркерними є реакції на мієлопероксидазу, ліпіди, глікоген, неспецифічну естеразу). Уточнення морфологічного варіанта гострої лейкемії дає змогу обрати найраціональнішу лікувальну тактику.
Диференціальну діагностику, як правило, доводиться проводити з гіпо- пластичною анемією та агранулоцитозом.
При гіпопластичній анемії, як і при гострій лейкемії, клінічно виявляють анемічний, геморагічний, гнійно-септичний синдроми, проте збільшення лімфатичних вузлів і селезінки відсутнє, у крові за наявності панцитопенії бластні клітини не виявляють, у пунктаті кісткового мозку відсоток бластних клітин у нормі. Важливе значення для діагностики має трепанобіопсія: жирове заміщення кісткового мозку свідчить про гіпопластичну анемію.
При агранулоцитозі гнійно-септичний синдром є провідним, відсутня анемія, не спостерігають геморагічних ускладнень та збільшення селезінки. У крові виявляють лейкопенію з вираженою гранулоцитопенією за нормальних показників червоного і тромбоцитарного ростків. У кістковому мозку кількість бластних клітин не перевищує норми, не виявляють редукції еритропоезу, є достатня кількість мегакаріоцитів.
Інфекційний мононуклеоз проявляється некротичною ангіною, гарячкою, лімфаденопатією, часто збільшенням печінки і селезінки. Такі симптоми дуже подібні до проявів гострої лейкемії. Однак у хворого на інфекційний мононуклеоз не виявляють анемії і підвищеної кровоточивості, стан хворого досить швидко поліпшується, нормалізується температура тіла, виліковується ангіна. Головними опорними пунктами в диференціальній діагностиці є морфологічні дослідження периферійної крові (при інфекційному мононуклеозі кількість еритроцитів і тромбоцитів у нормі, лейкоцитоз з лімфо- цитозом, часто моноцитозом і наявністю мононуклеарів від 15 до 60% і більше). Оцінювання показників крові в динаміці, отримання однотипних змін, відсутність у крові бластних клітин свідчать про відсутність гострої лейкемії.
Певні труднощі можуть виникнути під час диференціальної діагностики гострої лейкемії і хронічної мієлоїдної лейкемії, що починається бластним кризом. Клінічні симптоми, зміни в крові й у кістковому мозку не дають змоги розмежувати ці два захворювання. Однак тут може допомогти хромосомний аналіз: у хворих на гостру лейкемію в проліферівних клітинах кісткового мозку Ph-хромосоми не виявляють.
Таким чином, остаточний діагноз гострої лейкемії суто морфологічний. Критерієм діагнозу є бластна трансформація кровотворення.
Варіанти перебігу гострої лейкемії. Окремі морфологічні форми гострої лейкемії мають деякі особливості клінічного перебігу.
Гостра мієлобластна лейкемія характеризується гострим початком і бурхливим розвитком клінічних симптомів. Зазвичай у хворого з’являються гарячка, біль у кістках, гіперплазія ясен, виразково-некротичні ураження слизових оболонок ротової порожнини, глотки, стравоходу, кишок. Анемія значно виражена, тромбоцитопенія зумовлює розвиток геморагічних ускладнень. Лімфатичні вузли і селезінка на ранніх етапах розвитку процесу не збільшені.
Гостра лімфобластна лейкемія розвивається переважно в дітей. У дорослих вона розвивається дещо повільніше, ніж мієлобластна. Її особливістю є збільшення лімфатичних вузлів, селезінки, печінки. Температура зазвичай субфебрильна, рідше досягає фебрилітету. Самопочуття хворих надовше залишається задовільним, повільніше розвиваються анемія й тромбоцитопенія. Метастазування процесу найчастіше спостерігається в мозкові оболони та яєчка.
Гостра промієлоцитна лейкемія відрізняється від інших форм більшою вираженістю геморагічних проявів, якими захворювання нерідко починається. Геморагії виникають у місцях травм, ін’єкцій, спостерігаються тяжкі маткові кровотечі, а також носові і ясенні. У патогенезі геморагій провідну роль відіграє розвиток ДВЗ-синдрому, зумовленого вивільненням тромбопластину з лейкемічних клітин, які розпадаються. Під час спеціального дослідження встановлено, що лейкемічні клітини містять на своїй поверхні й у цитоплазмі надлишок тромбопластину. 70% хворих з гострою промієлоцитар- ною лейкемією вмирають від крововиливів у мозок.
Гострий еритромієлоз у більшості випадків характеризується анемічним синдромом, що наростає повільно і супроводжується появою помірної жовтяниці. Часто із самого початку захворювання виявляють лейко- і тромбоцитопенію. Якоїсь типової органної патології не відзначають; лімфатичні вузли, печінка та селезінка в більшості хворих залишаються в нормі. У кістковому мозку збільшується кількість клітин червоного ряду, здатних диференціюватися до оксифільних нормобластів і еритроцитів, і лише згодом виявляють бластоз.
Ускладнення гострої лейкемії розвиваються на всіх етапах хвороби і характеризуються геморагіями, нерідко смертельними, гнійно-септичними і виразково-некротичними процесами, ураженням центральної нервової системи.
Лікування гострої лейкемії
Установлення діагнозу гострої лейкемії в усіх випадках потребує невідкладної активної терапії. Основним принципом лікування гострої лейкемії є поліхіміотерапія, яка спрямована на викорінювання (ерадикацію) лейкемічно- го клону клітин, досягнення ремісії та максимального її продовження. Лікування слід здійснювати в умовах спеціалізованого стаціонару. Нині для лікування гострої лейкемії використовують такі групи препаратів: глюкокор-тикостероїди, що гальмують процеси проліферації, особливо в лімфоїдних клітинах, справляють часткову захисну дію стосовно нормальних клітин — попередниць гемопоезу, дезінтоксикаційну, гемостатичну дію внаслідок зменшення судинної проникності.
Антиметаболіти: 6-меркаптопурин, тіогуанін, метотрексат (аметоптерин), цитозин-арабінозид (цитозар, алексан) вступають у конкурентні відносини з метаболітами лейкемічної бластної клітини у фазу синтезу нуклеїнових кислот, що призводить до порушення їхнього синтезу.
Рослинні алкалоїди: вінкристин (онковін), вінбластин (розевін) вибірково блокують мітоз у стадії метафази, затримують ріст злоякісних лейкемічних клітин.
Алкілувальні сполуки: циклофосфан (циклофосфамід, ендоксан), взаємодіє з нуклеофільними групами, порушуючи синтез ДНК- і РНК-клітин.
Протипухлинні антибіотики: рубоміцин (дауноміцин, даунорубіцин), карміноміцин, адріаміцин (адріабластин, доксорубіцин) — інгібують ріст лейкемічних клітин, пригнічуючи синтез нуклеїнових кислот.
Ферментні препарати: L-аспарагіназа (краснітин) порушує метаболізм аспарагіну, який необхідний лейкемічним клітинам для їхнього розвитку, що призводить їх до загибелі.
Етопозид (теніпозид) — блокує лейкемічні клітини у фазі G2, гальмує клітинний цикл, затримує проліферацію клітин.
Диференціювальні агенти: каротини, ретиноїди (весаноїд, транс-рети- ноєва кислота) можуть викликати диференціацію пухлинних клітин.
Похідні нітрозосечовини: BCNU (кармустин), CCNU (ломустин) — за механізмом дії належать до алкілувальних сполук.
Антрацендіони: мітоксантрон, амсакрин — не містять амінних цукрів, за дією подібні до антрациклінів.
Програми поліхіміотерапії включають комбінації протипухлинних препаратів циклоспецифічних (що діють в одній або кількох фазах мітотичного циклу лейкемічної бластної клітини) і цитонеспецифічних (в основному ЭЛ- кілувальних засобів), що можуть порушувати структуру ДНК у будь-якій функціональній стадії мітозної клітини. Такі комбінації препаратів дають змогу охопити спектром їх спільної дії лейкемічні бластні клітини у всіх фазах клітинного циклу й у стані спокою і таким чином забезпечити максимальне їх знищення.
Дози цитостатичних препаратів визначають із розрахунку на 1 м2 поверхні тіла, яку обраховують за номограмою.
Відповідно до поділу гострої лейкемії на стадії процесу (перший гострий період, ремісія, рецидив) розрізнюють кілька етапів терапії: перший етап — індукція ремісії — проведення курсової цитостатичної хіміотерапії за найефективнішою для цього морфологічного варіанта програмою. Профілактику нейролейкемії проводять не лише у хворих на гостру лімфобластну лейкемію, за якої найімовірніший розвиток нейролейкемії, а й у хворих на не- лімфобластні лейкемії. Профілактика включає опромінення голови в дозі 24 Гр і 5 ендолюмбальних уведень метотрексату.
У процесі лікування здійснюють систематичний ретельний контроль за показниками крові та кісткового мозку. Розвиток індукованої гіпоплазії кровотворення є неодмінною умовою настання клініко-гематологічної ремісії і може супроводжуватися низкою тяжких ускладнень (гнійно-септичних на тлі глибокої гранулоцитопенії; геморагічних, зумовлених тромбоцитопенією) та потребувати невідкладного застосування комплексу лікувальних заходів.
Після досягнення ремісії проводять її консолідацію (закріплення), спрямовану на повну ерадикацію лейкемічних клітин і пригнічення "дрімотної" лейкемічної популяції. З цією метою проводять постійну підтримувальну терапію 6-меркаптопурином, метотрексатом і циклофосфаном відповідно до програми протоколу. Лікування рецидиву гострої лейкемії є дуже складним завданням і вимагає поновлення курсів індукційної терапії, а в разі розвитку резистентності — щадної терапії для підтримання стану клінічної компенсації.
Вибір програм поліхіміотерапії визначають з урахуванням морфологічного варіанта гострої лейкемії.
Лікування гострої лімфобластної лейкемії у дорослих. Базовою програмою індукції ремісії ГЛЛ є двофазна програма Hoelzer — застосування вінкристи- ну, доксорубіцину, преднізолону, L-аспарагінази, циклофосфану. Доповнення програми антрацикліновими антибіотиками або L-аспарагіназою підвищує кількість ремісій до 70—80%. Широко використовують схеми терапії ВРП (вінкристин, рубоміцин, преднізолон), ЦВРП (циклофосфан, вінкристин, рубоміцин, преднізолон), ПОМП (6-меркаптопурин (пуринетол), онковін, метотрексат, преднізолон), ВЛАП (вінкристин, L-аспарагіназа, преднізолон) тощо.
Лікування гострої нелімфобластної лейкемії. Найефективнішим є поєднання цитозару і рубоміцину (або карміноміцину) у схемах "7 + 3", "5 + 2"; високу активність має програма ОАП (онковін, цитозин-арабіноза, преднізолон) зі щоденним безперервним внутрішньовенним краплинним уведенням цитозару. Залучення до програми вінкристину, 6-меркаптопурину, тіогуаніну, амсакрину не покращує ефективності терапії.
Монохіміотерапія можлива у хворих похилого віку, за наявності тяжких супутніх захворювань (цукровий діабет, туберкульоз тощо), а також у разі повільного прогресування захворювання з помірною інфільтрацією кісткового мозку (20—40%) і майже нормальними показниками периферійної крові.
При гострих лейкеміях допоміжна терапія спрямована на підтримання стану клінічної компенсації хворих, які отримують хіміотерапію. Вона включає трансфузійну терапію — замісні переливання за показаннями еритроцитної маси, тромбоцитного концентрату. У зв’язку з розвитком у хворих вираженої інтоксикації, зумовленої лейкемічним процесом і токсичним впливом поліхіміотерапії, у стадії індукції ремісії необхідно проводити дезінтоксикаційне лікування. Ефективні неогемодез, розчини альбуміну, сольові розчини, сорбілакт, 15% розчин маніту, реополіглюкін; застосовують також метод гемодилюції і форсованого діурезу, гемосорбцію, плазмаферез.
Вплив цитостатичної терапії і зменшення маси нормальних елементів кісткового мозку призводять до різкого звуження "плацдарму" й активності гемопоезу з розвитком цитопенії. Небезпека розвитку цитопенічного синдрому полягає в можливому виникненні на його тлі різноманітних тяжких інфекційних ускладнень, геморагій, некротичної ентеропатії.
Інфекційні процеси спостерігають у 80—85% хворих з гострою лейкемією. Вони призводять до смерті понад половини хворих. Зазвичай такі процеси спричинюються стафілококом, синьогнійною і кишковою паличками, грибами роду Candida. У розвитку інфекційних ускладнень важлива роль належить гранулоцитопенії і порушенням імунологічного захисту. Основним методом лікування інфекційних ускладнень при гострій лейкемії є своєчасна й адекватна антибактеріальна терапія із застосуванням антибіотиків широкого спектра дії та їх комбінацій, вибір антибіотиків відповідно до чутливості мікрофлори. Для відновлення імунологічного захисту застосовують стимулятори природного імунітету та засоби замісної терапії імунобіологічної спрямованості: препарати гаммаглобуліну, лізоцим, інтерферон, продигіозан.
Для профілактики інфекційних ускладнень у хворих із вираженою гранулоцитопенією доцільна їх ізоляція і напівізоляція, створення в ізоляторі стерильних умов, ретельний догляд за шкірою та слизовими оболонками ротової порожнини, стерилізація кишок через призначення неадсорбованих антибіотиків — гентоміцину, ристоміцину, ністатину.
Геморагічні ускладнення купіруються переливаннями концентрату тромбоцитів по 2-4 дози (1 доза — 0,7 • 10" клітин) 2—3 рази на тиждень.
Хворим з промієлоцитарною гострою лейкемією для боротьби з геморагічним синдромом, зумовленим дисемінованим внутрішньосудинним згортанням крові, призначають гепарин, контрикал, кріопреципітат, інфузії свіжо- замороженої плазми за суворого контролю коагулограми.
Останнім часом розробляються методи імунотерапії гострої лейкемії для того, щоб зняти імунологічну толерантність організму щодо лейкемічного агента й організувати активну імунологічну відповідь, здатну контролювати і пригнічувати неопластичний ріст. Обнадійливі результати отримано після проведення трансплантації кісткового мозку у хворих на гостру лейкемію.
Прогноз при гострій лейкемії залежить від багатьох факторів, значущість яких може змінюватися залежно від характеру поліхіміотерапії, чутливості до лікування, розвитку ускладнень. Важливе значення для індукції ремісії та її тривалості має вік хворих. У дорослих віком до 30 років, які хворіють на гострий лімфобластний лейкоз, удається домогтися ремісій у 80—90% випадків, а у хворих віком понад 30 років — лише в 60—70%. У хворих на гострий мієлобластний лейкоз віком до 30 років ремісії індукуються в 95% випадків, а у хворих віком понад 50 років — лише в 55%.
Задовільний компенсований стан хворого є позитивною прогностичною ознакою. Прогностично несприятливими є високий (понад 20 • 109/л) лейкоцитоз, бластоз (понад 50 • 109/л), анемія (гемоглобін менше ніж 90 г/л), тромбоцитопенія (тромбоцитів менше ніж 30 • 109/л).
Найбільше значення для прогнозу захворювання має адекватна терапія. Методи профілактики гострої лейкемії ще не розроблені.
Подальша інформація
Завжди консультуйтеся зі своїм лікарем, щоб переконатися, що інформація, яка відображається на цій сторінці, може бути застосована до ваших особистих обставин. Інформація призначена тільки для медичних фахівців.