- Склад
- Лікарська форма
- Фармакотерапевтична група
- Фармакологічні властивості
- Клінічні характеристики
- Показання
- Протипоказання
- Взаємодія з іншими засобами
- Особливості застосування
- У період вагітності
- При керуванні автомобілем
- Спосіб застосування та дози
- Діти
- Передозування
- Побічні реакції
- Термін придатності
- Умови зберігання
- Упаковка
- Категорія відпуску
- Виробник
- Місцезнаходження виробника
Каржест інструкція із застосування
Офіційна інструкція лікарського засобу Каржест порошок 100 мг, 500 мг. Опис та застосування Karzhest, аналоги та відгуки. Інструкція Каржест порошок затверджена виробником.
Склад
діюча речовина: пеметрексед;
1 флакон містить 100 мг або 500 мг пеметрекседу (у вигляді пеметрекседу динатрію);
допоміжні речовини: маніт (Е 421), натрію гідроксид, кислота хлористоводнева, вода для ін’єкцій, азот.
Лікарська форма
Порошок ліофілізований для приготування концентрату для розчину для інфузій.
Основні фізико-хімічні властивості:
Ліофілізований порошок від білого до світло-жовтого, або зелено-жовтого кольору.
Фармакотерапевтична група
Антиметаболіти. Структурні аналоги фолієвої кислоти.
Код ATXL01B А04.
Фармакологічні властивості
Фармакодинаміка.
Пеметрексед є протипухлинним антифолатним засобом. Дослідження in vitro продемонстрували, що пеметрексед виступає антифолатним засобом різноспрямованої дії, пригнічуючи тимідилатсинтетазу (TS), дегідрофолатредуктазу (DHFR) і гліцинамід- рибонуклеотид-формілтрансферазу (GARFT), які є основними фолатзалежними ферментами для біосинтезу тимідину та пуринових нуклеотидів de novo, необхідні для реплікації клітин. Транспорт пеметрекседу до клітини відбувається за рахунок як редукованого переносника фолатів, так і транспортних систем мебранного протеїну, що зв’язує фолати. Потрапивши до клітини, пеметрексед трансформується в поліглютаматні форми за допомогою ферменту фолілполіглютаматсинтетази. Поліглютаматні форми є навіть більш сильними інгібіторами TS і GARFT, ніж пеметрексед. Поліглютамація є процесом, що залежить від часу та концентрації і відбувається в пухлинних клітинах і меншою мірою - у здорових тканинах. Метаболіти поліглютамату мають більш тривалий внутрішньоклітинний період напіввиведення, ніж вихідний лікарський засіб, що призводить до більш тривалої дії препарату в малігнізованих клітинах. Дані свідчать, що надекспресія тимідилатсинтази (TS) корелює зі зниженою чутливістю до пеметрекседу в ліній клітин, стійких до антифолатів. Результати дослідження зразків пацієнтів з недрібноклітинним раком легень (НДРЛ), які раніше не проходили курс хіміотерапії, показали зниження рівня експресії TS при аденокарциномі порівняно з пухлинами плоскоклітинпої карциноми. Ці дані вказують на те, що пеметрексед може мати більшу ефективність для пацієнтів з аденокарциномою, порівняно з гістологією плоскоклітинної карциноми.
Досліди in vitro з клітинною лінією мезотеліоми MSTO-211H продемонстрували синергічні ефекти при комбінуванні пеметрекседу з цисплатином.
Фармакокінетика:
Абсорбція
Пеметрексед призначений лише для внутрішньовенного введення.
Розподіл
Пеметрексед має сталий об'єм розподілу, шо дорівнює 9 л/м2. Дослідження in vitro показали, що приблизно 81 % пеметрекседу зв'язується протеїнами плазми. Ступінь ниркової недостатності не впливає на зв'язування препарату.
Метаболізм
Пеметрексед підлягає обмеженому печінковому метаболізму.
Виведення
70-90 % введеної дози пеметрекседу виводиться переважно із сечею в незміненому вигляді протягом перших 24 годин після застосування. Дослідження in vitro показали, що пеметрексед активно виводиться ОАТЗ (транспортер органічних аніонів). Загальний плазмовий кліренс пеметрекседу становить 92 мл/хв, а період напіввиведення з плазми - 3,5 години в пацієнтів з нормальною функцією нирок (кліренс креатиніну 90 мл/хв). Загальний системний вплив пеметрекседу (AUC) та максимальна концентрація в плазмі зростають пропорційно підвищенню дози. Фармакокінетика пеметрекседу є сталою протягом множинних циклів лікування. На фармакокінетичні властивості пеметрекседу не впливає супутнє застосування цисплатину. Застосування перорально добавки фолієвої кислоти та внутрішньом’язове застосування добавки вітаміну В12 не впливає на фармакокінетику пеметрекседу.
Пацієнти літнього віку
Не спостерігалося зв'язку між віком та фармакокінетикою пеметрекседу
у діапазоні віку від 26 до 80 років.
Пацієнти з печінковою недостатністю
Не спостерігалося зв'язку між рівнями АсАт (SGOT), АлАт (SGPT), загального білірубіну та фармакокінетикою пеметрекседу. Однак вплив препарату в пацієнтів з порушеннями функції печінки (див. розділ «Особливості застосування») окремо не вивчали.
Пацієнти з нирковою недостатністю
З фармакокінетичного аналізу пацієнтів зі зниженою функцією нирок відомо, що загальний плазмовий кліренс і нирковий кліренс пеметрекседу знижуються зі зменшенням функції нирок. У середньому, у пацієнтів із кліренсом креатиніну 45 мл/хв загальний системний вплив пеметрекседу (AUC) на 56 % більше порівняно з пацієнтами з кліренсом креатиніну 90 мл/хв. (див. розділи «Особливості застосування» та «Спосіб застосування та дози»).
Клінічні характеристики
Каржест Показання
Злоякісна мезотеліома плеври.
Пеметрексед в комбінації з цисплатином показаний для лікування пацієнтів, які раніше не отримували хіміотерапевтичного лікування, зі злоякісною неоперабельною мезотеліомою плеври.
Недрібноклітинний рак легенів.
Пеметрексед в комбінації з цисплатином показаний для лікування хворих на місцеворозповсюджений або метастатичний недрібноклітинний неплоскоклітинний рак легенів у першій лінії хіміотерапії.
Пеметрексед як монотерапія показаний для підтримуючого лікування хворих на місцеворозповсюджений або метастатичний недрібноклітинний неплоскоклітинний рак легенів, у яких не було прогресування захворювання відразу після попередньої хіміотерапії препаратами платини.
Пеметрексед як монотерапія показаний для лікування хворих на місцеворозповсюджений або метастатичний недрібноклітинний неплоскоклітинний рак легенів у другій лінії хіміотерапії.
Протипоказання
- Гіперчутливість до пеметрекседу або до будь-якої з допоміжних речовин препарату.
- Період годування груддю.
- Супутнє застосування з вакциною проти жовтої лихоманки.
Особливі заходи безпеки
Як і під час роботи з іншими потенційно отруйними протипухлинними препаратами, слід приділяти велику увагу заходам безпеки при приготуванні та застосуванні розчину пеметрекседу. Рекомендується використовувати рукавички. У разі, якщо розчин псметрекседу потрапив на шкіру, слід негайно промити шкіру водою з милом. Якщо розчин пеметрекседу потрапив на слизові оболонки, слід ретельно промиити водою. Пеметрексед не має шкірно-наривних властивостей. Не існує специфічного антидоту у разі екстравазації (виходу препарату у позасудинний простір) пеметрекседу. Було зареєстровано декілька випадків екстравазації пеметрекседу, які не були віднесені спостерігачами до серйозних. Надавати допомогу в разі екстравазації препарату слід відповідно до локальних стандартів медичного закладу.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Пеметрексед виводиться переважно нирками в незміненому вигляді, шляхом клубочкової фільтрації та і тубулярної секреції. Дослідження in vitro показали, що пеметрексед активно виводиться ОАТЗ (транспортер органічних аніонів) нирки. Дослідження in vitro також вказують на спорідненість пеметрекседу з ОАТ4, проте роль ОАТ4 у виведенні молекул нирками ще не повністю відома. Супутнє застосування нефротоксичних препаратів (наприклад аміноглікозидів. петльових діуретиків, препаратів платини, циклоспорину) та/або речовин, які виводяться шляхом тубулярної секреції (пробенецид, пеніцилін), може призводити до зниження кліренсу пеметрекседу. Подібні комбінації слід застосовувати з обережністю. За необхідності кліренс креатиніну слід ретельно контролювати.
Пеметрексед піддасться незначному метаболізму в печінці. Результати досліджень in vitro з мікросомами печінки людини дають можливість припустити, що пеметрексед клінічно значуще не інгібує кліренс препаратів, які метаболізуються за допомогою CYP3A, CYP2D6, CYP2C9 і CYP1A2.
Застосування перорально добавки фолієвої кислоти та внутрішньом'язове застосування добавки вітаміну В12 не впливає на фармакокінетику пеметрекседу. Застосування пеметрекседу не впливає на загальний кліренс платини.
Хоча в пацієнтів з нормальною нирковою функцією (кліренс креатиніну > 80 мл/хв) НПЗЗ в помірних дозах можуть бути супутньо застосовані разом з псметрекседом, нирковий кліренс зменшувався на 16 % під час застосування ібупрофену супутньо з псметрекседом у пацієнтів з нормальною функцією нирок. У пацієнтів з нормальною нирковою функцією високі дози нестероїдних протизапальних препаратів (НПЗП, таких як ібупрофен >1600 мг/добу) та ацетилсаліцилової кислоти (> 1,3 г/добу) можуть знижувати виведення пеметрекседу і, таким чином, підвищувати частоту виникнення побічних реакцій. Тому слід з обережністю призначати високі дози нестероїдних протизапальних препаратів або ацетилсаліцилової кислоти разом з псметрекседом пацієнтам з нормальною нирковою функцією. Пацієнтам з нирковою недостатністю легкого та середнього ступеня тяжкості (кліренс креатиніну 45-79 мл/хв) слід уникати супутнього застосовування пеметрекседу з НПЗП (наприклад ібупрофеном або ацетилсаліциловою кислотою). Пацієнтам з нирковою недостатністю легкого та середнього ступеня тяжкості слід уникати застосування НПЗП з коротким періодом напіврозпаду протягом 2 днів до застосування пеметрекседу, в день його застосування та протягом 2 днів після застосування.
За відсутності даних відносно потенційної взаємодії з НПЗП, які мають тривалий період напіврозпаду, таких як піроксикам або рофекоксиб, супутнє застосування цих препаратів пацієнтам з нирковою недостатністю легкого та середнього ступеня тяжкості слід припинити за 5 днів до застосування пеметрекседу, в день його застосування та протягом 2 днів після цього. Якщо супутнє застосування НПЗП необхідне, слід ретельно контролювати стан пацієнта щодо явищ токсичності, особливо міслосупресії та шлунково-кишкової токсичності.
Взаємодії, притаманні усім цитотоксинам.
Через підвищений ризик тромбоутворення онкохворим часто застосовують антикоагулянту терапію. Висока індивідуальна варіабельність коагуляційного статусу протягом хвороби та ймовірність взаємодії між псроральними антикоагулянтами та препаратами протипухлинної хіміотерапії вимагають підвищення частоти контролю МНВ (міжнародне нормалізоване відношення), якщо було прийнято рішення про застосування пероральних антикоагулянтів таким пацієнтам.
Сумісне застосування протипоказане: вакцина проти жовтої лихоманки - через ризик розвитку летальної генералізовапої вакцинної хвороби (див. розділ «Протипоказання»).
Сумісне застосування не рекомендується: живі ослаблені вакцини (крім вакцини проти жовтої лихоманки, для якої сумісне застосування протипоказане) - через ризик системного, можливо летального, захворювання. Ризик підвищується у разі, якщо пацієнт вже має імуносупресію через наявне захворювання. У такому випадку слід використовувати інактивовану вакцину, якщо така існує (наприклад, вакцина проти поліомієліту).
Особливості застосування
Пеметрексед слід застосовувати під наглядом кваліфікованого лікаря з досвідом лікування протипухлинними препаратами. Належне управління ускладненнями можливе лише за наявності відповідного діагностичного та лікувального обладнання.
Пеметрексед може пригнічувати функцію кісткового мозку, що проявляється у вигляді анемії, нейтропенії, тромбоцитопенії, або панцитопенії. (див. розділ «Побічні реакції»), Мієлосупресія, зазвичай, є дозолімітуючою токсичністю. Протягом лікування у пацієнтів слід контролювати мієлосупресію, а пеметрексед не слід застосовувати пацієнтам до повернення абсолютного числа нейтрофілів (ANC) до значення > 1,5 х 109/л, а числа тромбоцитів до значення > 100 х109/л. Зменшення дози в наступних циклах базується на таких показниках: мінімальне значення абсолютної кількості нейтрофілів (ANC), кількість тромбоцитів та максимально сильні прояви негематологічної токсичності, що спостерігались у попередньому циклі лікування (див. розділ «Спосіб застосування та дози»).
Пацієнтам, які отримують терапію пеметрекседом, слід рекомендувати прийом фолієвої кислоти та вітаміну В12 з пеметрекседом із профілактичною метою, для зменшення пов'язаної з терапією токсичності, (див. розділ «Спосіб застосування та дози»). У дослідженні мезотеліоми повідомлялось про меншу загальну токсичність і зниження гематологічної і негематологічної токсичності 3/4-го ступеня, такої як нейтропенія, фебрильна нейтропенія та інфекція з нейтропенією 3/4-го ступеня, якщо попередньо застосовувалися фолієва кислота та вітамін В12.
Тяжкі ниркові розлади, зокрема гостра ниркова недостатність, спостерігалися як при монотерапії пеметрекседом, так і при застосуванні в комбінації з іншими хіміотерапевтичними препаратами. Більшість пацієнтів, у яких виникали такі розлади, мали фактор ризику виникнення ниркових розладів, зокрема зневоднення, артеріальну гіпертензію або діабет. У постмаркетинговому періоді повідомлялось про випадки нецукрового ниркового діабету та некрозу ниркових канальців як при монотерапії пеметрекседом, так і при застосуванні в комбінації з іншими хіміотерапевтичними препаратами. Більшість з цих випадків зникали після відміни пеметрекседу. За станом пацієнтів слід уважно спостерігати, на предмет можливого розвитку гострого тубулярного некрозу або порушення ниркової функції, ознак та симптомів нефрогенного нецукрового діабету (наприклад, гіпернатріємія).
Спостерігалися випадки тяжкого зневоднення, пов'язаного зі шлунково-кишковою токсичністю при застосуванні пеметрекседу в комбінації з цисплатином. Тому пацієнтам слід призначати адекватну протиблювотну терапію та відповідну гідратацію до та/або після лікування.
Серйозні серцево-судинні події, зокрема інфаркт міокарда та цереброваскулярні порушення, нечасто спостерігалися під час клінічних досліджень пеметрекседу, зазвичай при призначенні комбінації пеметрекседу з іншими цитотоксичними препаратами. Більшість пацієнтів, у яких такі випадки були зареєстровані, мали попередні серцево-судинні фактори ризику.
У більшості онкохворих пацієнтів спостерігається пригнічення функції імунної системи. Тому сумісне застосування живих ослаблених вакцин не рекомендоване.
Випадки променевого пневмоніту реєструвалися в пацієнтів, які отримували променеву терапію до, під час або після терапії пеметрекседом. Таким пацієнтам повинна приділятися особлива увага і їм треба з особливою обережністю використовувати інші радіосенсибілізуючі препарати. Повідомлялося про випадки місцевих запальних реакцій попередньо опромінених ділянок у пацієнтів, які отримували променеву терапію за тижні або роки раніше.
Пацієнти з нирковою недостатністю
Пеметрексед виводиться переважно нирками в незміненому вигляді. Клінічний досвід застосування препарату пацієнтам з кліренсом креатиніну нижче 45 мл/хв обмежений. Тому не слід застосовувати пеметрексед пацієнтам із кліренсом креатиніну < 45 мл/хв (див. розділ «Спосіб застосування та дози»).
Пацієнтам з нирковою недостатністю легкого та середнього ступеня тяжкості (кліренс креатиніну 45-79 мл/хв) слід уникати супутнього застосовування пеметрекседу з НПЗП, такими, як ібупрофен, ацетилсаліцилова кислота (> 1,3 г/добу) за два дні до застосування, у день застосування та 2 дні після застосування пеметрекседу).
Пацієнти з легким та помірним ступенем ниркової недостатності, для яких прийнятна терапія пеметрекседом, супутнє застосування НПЗП із тривалим періодом напіввиведення слід припинити як мінімум за 5 днів до застосування, у день застосування, та 2 дні після застосування пеметрекседу (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Пацієнти з печінковою недостатністю
Пеметрексед піддасться незначному метаболізму в печінці. Вплив препарату в пацієнтів з порушеннями функції печінки, такими як підвищення рівня білірубіну в > 1,5 рази від верхньої межі норми (ВМН) або амінотрансферази в > 3 рази від ВМН (відсутні метастази в печінці), або в > 5 разів від ВМН (наявні метастази в печінці), окремо не вивчали.
Реакції з боку шкіри спостерігались у пацієнтів, які попередньо не отримували терапію кортикостероїдами. Попереднє лікування дексаметазоном (або еквівалентом) може зменшувати кількість випадків і ступінь тяжкості шкірних реакцій (див. розділ «Спосіб застосування та дози»).
Більшість побічних ефектів, пов'язаних з лікуванням пеметрекседом у клінічних дослідженнях, були зворотними.
Вплив на пеметрексед порожнинних рідин, таких як плевральний випіт та асцит, не встановлений повною мірою. Перед призначенням пеметрекседу пацієнтам зі значним об'ємом порожнинної рідини слід розглянути питання про доцільність дренування.
Генотоксичність
Пеметрексед може спричинити генетичні порушення. Статево зрілим чоловікам не рекомендується планувати батьківство протягом лікування пеметрекседом та протягом 6 місяців після терапії. Рекомендується використовувати засоби контрацепції або утриматись від статевих контактів.
Фертильність
Пеметрексед може спричиняти необоротне безпліддя, тому чоловікам рекомендується вжити заходів щодо зберігання сперми перед початком лікування пеметрекседом.
Жінки, які можуть завагітніти, повинні використовувати ефективні засоби контрацепції протягом лікування пеметрекседом.
Дослідження для оцінки канцерогенного потенціалу пеметрекседу не проводилися.
Повідомлялось про випадки «радіаційної пам'яті» у пацієнтів, які отримували лікування у попередні тижні або роки.
Застосування у період вагітності або годування груддю
Контрацепція
Жінки дітородного віку повинні використовувати ефективні засоби контрацепції протягом лікування пеметрекседом.
Вагітність
Не слід застосовувати пеметрексед у період вагітності через потенційну небезпеку для плоду. Застосування пеметрекседу у період вагітності може викликати серйозні вроджені вади. У дослідженнях на тваринах пеметрексед виявив тератогенну дію (включаючи розщеплення тканин піднебіння), також спостерігались інші токсичні ефекти на ембріофетальний розвиток (ембріофетальна загибель, зниження ваги плоду та неповна осифікація).
Годування груддю
Невідомо, чи проникає пеметрексед у молоко людини. Не виключено появи побічних реакцій у немовлят, що знаходяться на грудному вигодовуванні. Тому під час лікування пеметрекседом слід припинити грудне вигодовування.
Вплив на фертильність
Зважаючи на властивість пеметрекседу спричиняти необоротне безпліддя, чоловікам рекомендується вжити заходів щодо зберігання сперми перед початком лікування пеметрекседом.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Не проводилося жодних досліджень здатності пеметрекседу впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами. Однак повідомлялося, що пеметрексед може спричиняти втому. Тому пацієнтам слід бути уважними під час керування автомобілем або іншими механізмами.
Спосіб застосування Каржест та дози
Пеметрексед слід застосовувати під наглядом кваліфікованого лікаря з досвідом лікування протипухлинними препаратами.
Застосування комбінації пеметрекседу з цисплатином:
Рекомендована доза пеметрекседу становить 500 мг/м2 площі поверхні тіла (ППТ) у вигляді внутрішньовенної інфузії, що вводиться протягом 10 хвилин у перший день кожного 21- денного циклу.
Рекомендована доза цисплатину становить 75 мг/м2 ППТ у вигляді інфузії, що вводиться протягом 2 годин, приблизно через 30 хвилин після завершення інфузії пеметрекседу в перший день кожного 21-денного циклу. Пацієнт повинен отримувати адекватну протиблювотну терапію та належну гідратацію до або/та після введення цисплатину. Детальні рекомендації щодо дозування цисплатину - див. інструкцію для медичного застосування цисплатину.
Застосування як монотерапії:
Для лікування недрібноклітинного раку легенів (НДРЛ) після попередньо проведеної хіміотерапії рекомендована доза пеметрекседу становить 500 мг/м2 ППТ у вигляді внутрішньовенної Інфузії, що вводиться протягом 10 хвилин у перший день кожного 21- денного циклу.
Режим премедикації
З метою зниження частоти та тяжкості реакцій з боку шкіри слід застосовувати кортикостероїди за день до призначення пеметрекседу, в день його призначення та в день після його введення. Доза кортикостероїду має бути еквівалентна 4 мг дексаметазону перорально двічі на день (див. розділ «Особливості застосування»).
Для зменшення токсичності пацієнтам, які отримують лікування пеметрекседом, необхідно призначити перорально низькі дози препаратів фолієвої кислоти або полівітаміни, що містять фолієву кислоту (350 - 1000 мкг), щоденно. Протягом 7-денного періоду перед першою дозою пеметрекседу слід прийняти не менше 5 доз фолієвої кислоти, прийом фолієвої кислоти повинен продовжуватися протягом усього курсу терапії та протягом 21 дня після введення останньої дози пеметрекседу. Пацієнтам також слід застосовувати вітамін В12 (1000 мкг) внутрішньом'язово 1 раз на день протягом тижня перед першою дозою пеметрекседу та 1 раз через кожні 3 цикли після цього. Наступні ін'єкції вітаміну Ви можна проводити в день введення пеметрекседу.
Лабораторний моніторинг і рекомендації щодо модифікації дози
Моніторинг
У пацієнтів, які отримують пеметрексед, перед кожним введенням слід перевіряти показники загального аналізу крові, включно з диференційованими значеннями лейкоцитів та тромбоцитів. Перед кожним проведенням хіміотерапії слід проводити біохімічний аналіз крові для оцінки функції печінки та нирок.
Абсолютна кількість нейтрофілів (ANC) повинна становити >1,5 х 109/л, а тромбоцитів - > 100 х 109/л перед проведенням будь-якого циклу хіміотерапії.
Кліренс креатиніну має бути > 45 мл/хв.
Рівень загального білірубіну повинен не більше ніж в 1,5 раза перевищувати нормальний. Рівень лужної фосфатази (ЛФ), аланінамінотрансферази (АлАт) та аспартатамінотрансферази (АсАт) не повинен перевищувати норму більше ніж в 3 рази. Прийнятним вважається перевищення рівнів ферментів ЛФ, АлАт та АсАт до 5 разів понад норму за умови наявності пухлини печінки.
Рекомендації щодо модифікації дози
Модифікація дози перед початком наступного циклу повинна ґрунтуватися на найменших значеннях гематологічних показників або па максимальній негематологічній токсичності після попереднього циклу терапії. Лікування можна припинити з урахуванням достатнього часу для відновлення. Після відновлення пацієнти повинні отримувати терапію відповідно до рекомендацій, наведених у таблицях 1-3. що відповідають застосуванню пеметрекседу як монотерапії або в комбінації з цисплатином.
Таблиця 1; Модифікація дози пеметрекседу (моногераиія або комбінована терапія) та цисплатину. Гематологічна токсичність
Найменше значення АКН* < 0,5 х 109/л та найменше значення тромбоцитів > 50 х 109/л. | 75 % попередньої дози (пеметрексед і цисплатин). |
Найменше значення тромбоцитів < 50 х 109/л без кровотечі, без урахування найменшого значення АКН | 75 % попередньої дози (пеметрексед і цисплатин). |
Найменше значення тромбоцитів < 50 х 109/л за наявністю кровотечіа, без урахування найменшого значення АКН. | 50 % попередньої дози (пеметрексед і цисплатин). |
* Критерії за версією загальних критеріїв токсичності (ЗКТ) Національного інституту раку, США, (СТС v2.0; NCI 1998) відповідають визначенню кровотечі > ЗКТ 2-го ступеня
* АКН - абсолютна кількість нейтрофілів
У разі виникнення в пацієнта ознак негематологічної токсичності (за винятком нейротоксичності) > 3 ступеня, лікування пеметрскседом слід припинити до досягнення більш низьких значень або таких значень, які б відповідали вихідним перед початком терапії в цього пацієнта. Продовжувати терапію слід відповідно до рекомендацій, викладених у таблиці 2.
Таблиця 2; Модифікація дози пеметрекседу (монотерапія або комбінована терапія) та цисплатину. Негематологічна токсичність a,b.
Доза пеметрекседу (мг/м2) | Доза цисплатину (мг/м2) | |
Будь-яка токсичність ступеня 3 або 4, окрім мукозиту | 75 % попередньої дози | 75 % попередньої дози |
Будь-яка діарея, що потребує госпіталізації (незалежно від ступеня), або діарея 3-го чи 4-го ступеня | 75 % попередньої дози | 75 % попередньої дози |
Мукозит 3-го чи 4-го ступеня | 50 % попередньої дози | 100 % попередньої дози |
а Критерії за версією загальних критеріїв токсичності Національного інституту раку, США (СТС v2.0; NCI 1998);
b Окрім нейротоксичность.
Рекомендована модифікація дози пемстрекседу і цисплатину в разі нейротоксичності наведена у таблиці 3. При нейротоксичності 3-го або 4-го ступеня терапію псмегрекседом слід припинити.
Таблиця 3: Модифікація дози пемстрекседу (моиотерапія або комбінована терапія) та цисплатину. Нейротоксичність
Ступінь ЗКТ * | Доза пеметрекседу (мг/м2) | Доза цисплатину (мг/м2) |
| 0-1 | 100 % попередньої дози | 100 % попередньої дози |
| 2 | 100 % попередньої дози | 50 % попередньої дози |
* загальні критерії токсичності Національного інституту раку, США, (СТС v 2.0; NCI 1998)
Терапію пеметрекседом слід припинити, якщо в пацієнта спостерігається будь-яка гематологічна або негематологічна токсичність 3-го або 4-го ступеня після зниження 2 доз, або негайно припинити, якщо спостерігається нейротоксичність 3-го або 4-го ступеня.
Пацієнти літнього віку
У ході клінічних досліджень не було жодних свідчень про те, що пацієнти віком від 65 років мають більш високий ризик розвитку побічних ефектів, аніж пацієнти віком до 65 років. Відсутня необхідність у зниженні доз, окрім рекомендованих для всіх пацієнтів.
Діти
Відсутні релевантні дані стосовно застосування пемстрекседу в педіатричній практиці для лікування злоякісної мезотеліоми плеври та недрібноклітинного раку легенів.
Пацієнти з нирковою недостатністю
Пеметрексед виводиться переважно нирками у незміненому вигляді. У процесі клінічних досліджень не було необхідності коригувати дози для пацієнтів із кліренсом креатиніну не нижче 45 мл/хв, окрім рекомендованих для всіх пацієнтів. Кількість пацієнтів із кліренсом креатиніну нижче 45 мл/хв була недостатньою для рекомендацій щодо дозування окремо для цієї групи пацієнтів. Таким чином, застосування пеметрекседу пацієнтам, у яких кліренс креатиніну < 45 мл/хв, не рекомендується [при використанні стандартної формули Кокрофта- Голта або швидкості клубочкової фільтрації (ШКФ), визначеної методом плазмового кліренсу Tc99m-DPTA].
Метод застосування
Застереження щодо приготування розчину та застосування пеметрекседу викладені в розділі «Особливі заходи безпеки». Пеметрексед слід вводити у вигляді внутрішньовенної інфузії протягом 10 хвилин у перший день кожного 21-денного циклу. Рекомендації із відновлення, розчинення та розведення препарату, рекомендації щодо приготування розчину для інфузій наведені нижче.
1. Слід дотримуватись правил асептики під час розчинення та подальшого розведення пеметрекседу для внутрішньовенної інфузії.
2. Розрахувати дозу та необхідну кількість флаконів пеметрекседу'. Кожен флакон містить надлишок пеметрекседу для забезпечення отримання дози, що зазначена на маркуванні.
3. Перед введенням розчинити вміст флакона 100 мг за допомогою 4,2 мл 0,9 % розчину натрію хлориду для ін'єкцій для отримання розчину, який містить 25 мг/мл пеметрекседу. НЕОБХІДНЕ ПОДАЛЬШЕ РОЗВЕДЕННЯ.
Вміст флакона 500 мг розчинити за допомогою 20 мл 0,9 % розчину натрію хлориду для ін'єкцій для отримання розчину, який містить 25 мг/мл пеметрекседу. pH отриманого розчину становить 6,6-7,8. НЕОБХІДНЕ ПОДАЛЬШЕ РОЗВЕДЕННЯ.
Обережно струсити кожен флакон до повного розчинення порошку. Отриманий розчин має бути прозорим, без сторонніх часток, колір від безбарвного до жовтого або зелено-жовтого кольору, що не впливає на якість препарату.
4. Необхідний об'єм отриманого розчину пеметрекседу далі потрібно розвести до 100 мл за допомогою 0,9 % розчину натрію хлориду і вводити у вигляді внутрішньовенної інфузії протягом 10 хвилин.
5. Розчин пеметрекседу для інфузій, приготовлений, як описано вище, є сумісним з інфузійними пакетами та наборами для введення інфузій з полівінілхлориду та поліолефіну.
6. Препарати для внутрішньовенного введення слід перевіряти візуально для виявлення сторонніх частинок і знебарвлення перед введенням. У разі наявності сторонніх часток розчин не можна застосовувати.
7. Розчин пеметрекседу призначений для одноразового індивідуального використання.
Розчинення та подальше розведення пеметрекседу для внутрішньовенної інфузії рекомендується лише 0,9 % розчином натрію хлориду. Пеметрексед фізично несумісний з розчинниками, що містять кальцій, зокрема з розчином Рінгера і лактатом Рінгера. Сумісність пеметрекседу з іншими препаратами і розчинниками не досліджувалася, тому його не рекомендується змішувати з будь-яким іншим препаратом.
Хімічна та фізична стабільність розчиненого ліофілізату та розчину для інфузій пеметрекседу спостерігалася протягом 24 годин після розчинення оригінального флакону за умови зберігання при температурі не вище 25°С. Проте, оскільки пеметрексед і рекомендований розчинник не містять протимікробних консервантів, з метою зменшення антимікробного ризику, приготовлений розчин для інфузій слід використати негайно.
Невикористаний лікарський засіб або відходи слід знищити відповідно до затверджених вимог медичного закладу.
Діти
Пеметрексед не рекомендується для застосування у пацієнтів молодше 18 років, оскільки безпека та ефективність препарату в цієї групи хворих не встановлена.
Передозування
Повідомлялося про такі симптоми передозування пеметрекседу, як нейтропенія, анемія, тромбоцитопенія, мукозит, сенсорна полінейропатія і висипання. Передбачувані ускладнення при передозуванні включають пригнічення функції кісткового мозку, що проявляється нейтропенією, тромбоцитопенією та анемією. Крім того, можливі інфекція як з лихоманкою, так і без неї, діарея та/або мукозит. У випадку підозри на передозування необхідно контролювати стан пацієнта, призначити відповідні аналізи, зокрема розгорнутий аналіз крові, та призначити симптоматичну терапію за необхідності. Під час лікування передозування пеметрекседу слід розглянути можливість застосування фолінату кальцію/фолінової кислоти або тимідину.
Побічні реакції
Побічні реакції при застосуванні пеметрекседу, як в монотерапії, так і при комбінованому застосуванні, про які найчастіше повідомлялося: супресія кісткового мозку, що проявляється у вигляді анемії, нейтропенії, лейкопенії та тромбоцитопенії, а також шлунково-кишкова токсичність, що проявляється як анорсксія, нудота, блювання, діарея, запор, фарингіт, мукозит і стоматит. Інші побічні реакції включають ниркову токсичність, підвищення рівня амінотрансфераз, алопецію, слабкість, дегідратацію, висипання, інфекцію/сепсис, нейропатію. Рідко повідомлялося про синдром Стівепса-Джонсона та токсичний епідермальний некроліз.
Пеметрекседу якості монотерапії(НДРЛ):
У Таблиці 4 зазначено частоту7 та тяжкість побічних ефектів, які спостерігалися у пацієнтів, відібраних випадковим шляхом для монотерапії пеметрекседом із застосуванням фолієвої кислоти та вітаміну Віг, а також пацієнтів, відібраних випадковим шляхом для монотерапії доцетакселом. У всіх пацієнтів був діагностований місцеворозповсюджений або метастатичний НДРЛ, і всі вони отримували попередню хіміотерапію.
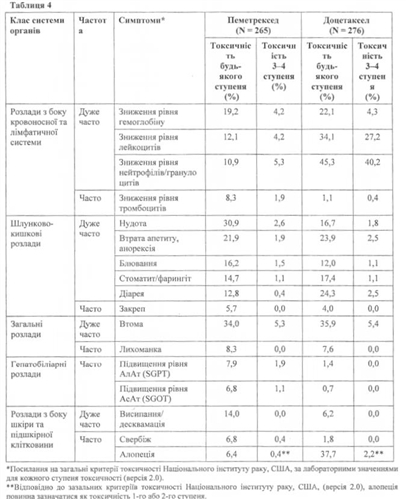
Дуже часто: > 10 %; Часто: > 5 % і < 10 % (у цій таблиці 5 % межа введена для включення всіх симптомів, які розглядалися як можливо пов'язані з пеметрекседом).
Клінічно значуща токсичність за загальними критеріями токсичності (ЗКТ), яка спостерігалася в > 1% та <5% пацієнтів, відібраних випадковим .шляхом для терапії пеметрекседом, включала сенсорну нейропатію, рухову нейропатію, біль у животі, підвищення рівня креатиніну, фебрильну нейтропенію, інфекцію без нейтропенії, алергічні реакції/гіперчутливість та мультиформну еритему.
Клінічно значуща, відповідно ЗКТ, токсичність, яка спостерігалася в < 1 % пацієнтів, відібраних випадковим шляхом для терапії пеметрекседом, включала надшлуночкові аритмії. Клінічно значущі лабораторні показники загальної токсичності 3-го та 4-го ступеня були подібні до інтегрованих результатів фази 2 у ході трьох досліджень монотерапії пеметрекседом та фази 3 у ході дослідження, яке було описано вище, за винятком нейтропенії та підвищення рівня аланінамінотрансферази. Ці розбіжності, ймовірно, були результатом розбіжностей у популяціях пацієнтів, оскільки дослідження фази 2 включали пацієнтів, які не отримували хіміотерапії, та тих, які отримували масивну попередню терапію раку молочної залози з раніше існуючими метастазами в печінку та/або вихідними відхиленнями печінкових тестів.
Комбінація з цисплатином (ЗМП):
У Таблиці 5 зазначено частоту та тяжкість побічних ефектів, які спостерігалися у пацієнтів з мезотеліомою, відібраних випадковим шляхом для терапії пеметрекседом і цисплатином, і пацієнтів з мезотеліомою, відібраних випадковим шляхом для монотерапії цисплатином. В обох групах лікування пацієнти, які не отримували хіміотерапії, отримували фолієву кислоту та вітамін В12 у повному обсязі.
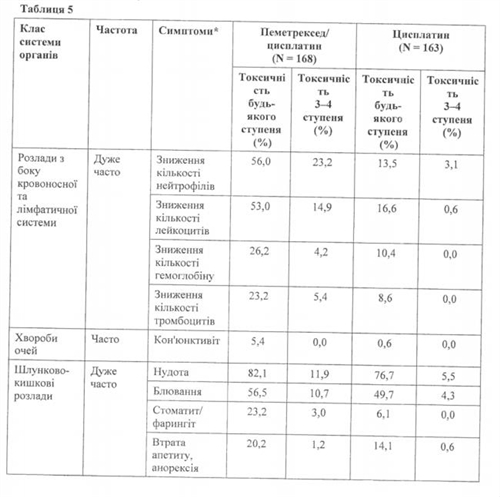
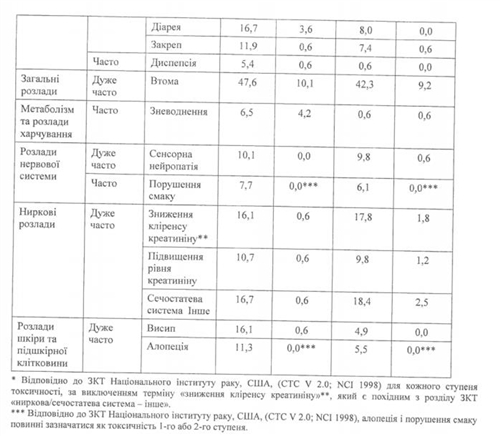
Дуже часто: > 10 %; Часто: > 5 % і < 10 % (у цій таблиці 5 % межа введена для включення всіх симптомів, які розглядалися як можливо пов'язані з пеметрекседом і цисплатином).
Клінічно значуща токсичність, відповідно ЗКТ, яка спостерігалася в > 1 % та < 5 % пацієнтів, відібраних випадковим шляхом для терапії цисплатином і пеметрекседом, включає підвищення рівня АсАт (SGOT), підвищення АлАт (SGPT) і ГГТ, інфекцію, фебрильну нейтропенію, ниркову недостатність, загруднинний біль, лихоманку і кропив'янку.
Клінічно значуща токсичність, яка спостерігалася в < 1 % пацієнтів, відібраних випадковим шляхом для терапії цисплатином і пеметрекседом, включала аритмію і рухову нейропатію.
Комбінація з цисплатином (НДРЛ):
У Таблиці 6 зазначено частоту та тяжкість побічних ефектів, які вважалися можливо пов'язаними з препаратом дослідження, і які спостерігалися у пацієнтів із НДРЛ, відібраних випадковим шляхом для терапії пеметрекседом і цисплатином, а також пацієнтів, відібраних випадковим шляхом для терапії цисплатином і гемцитабіном. Всі пацієнти отримували лікування препаратом дослідження в якості терапії першої лінії при місцеворозповсюдженому або метастатичному НДРЛ, і всі пацієнти в обох групах лікування отримували фолієву кислоту та вітамін В12 у повному обсязі.
Таблиця 6.
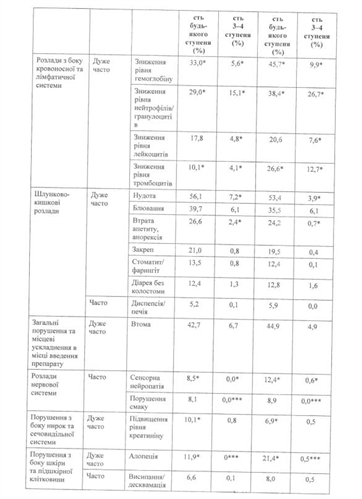
* Р-значення < 0,05 при порівнянні комбінацій пеметрексед/цисплатин та гемцитабін/цисплатин, отримане з використанням точного тесту Фішера. ** Відповідно до ЗКТ Національного інституту раку, США, (СТС V 2.0; NCI 1998) для кожного ступеня токсичності.
*** Відповідно до загальних критеріїв токсичності Національного інституту раку, США, (СТС V 2.0; NCI 1998), алопеція і порушення смаку повинні зазначатися як токсичність 1-го або 2-го ступеня.
Дуже часто: > 10 %; Часто: > 5 % і < 10 %. У цій таблиці 5 % межа введена для включення всіх симптомів, які розглядалися як можливо пов'язані з пеметрекседом і цисплатином.
Клінічно значуща токсичність, яка спостерігалася у клінічних дослідженнях в > 1 % і < 5 % пацієнтів, відібраних випадковим шляхом для терапії цисплатином і пеметрекседом, включала: підвищення рівня АсАт, підвищення АлАт, інфекцію, фебрильну нейтропенію, ниркову недостатність, лихоманку, дегідратацію, кон'юнктивіт та зниження кліренсу креатиніну.
Клінічно значуща токсичність, яка спостерігалася в < 1 % пацієнтів, відібраних випадковим шляхом для терапії цисплатином і пеметрекседом, включала: підвищення рівнів ГГТ, загруднинний біль, аритмію і рухову нейропатію. Гостра ниркова недостатність спостерігалася частіше в групі пеметрексед/цисплатин (6 випадків, 0,7 %), ніж у групі гемцитабін/цисплатин (0 випадків).
Пеметрексед у якості монотерапії (підтримуюча терапія при НДРЛ)
Частота та тяжкість побічних ефектів, які розглядалися у клінічних дослідженнях як можливо пов'язані з препаратом дослідження і спостерігалися у пацієнтів, відібраних випадковим шляхом для монотерапії пеметрекседом, а також 402 пацієнтів, відібраних випадковим шляхом для терапії плацебо, під час дослідження з застосуванням виключно пемстрекседу для підтримуючої терапії та для терапії пеметрекседом в ході дослідження тривалої підтримуючої терапії. У всіх пацієнтів був діагностований НДРЛ ПІВ або IV ступеня, і їм попередньо застосовувалася хіміотерапія препаратами платини. Пацієнти в обох групах лікування отримували фолієву кислоту та вітамін В12 у повному обсязі.
Клінічно значуща токсичність, яка спостерігалася в > 1 % і < 5 % (часто) пацієнтів, відібраних випадковим шляхом для терапії пеметрекседом, включає: зменшення кліренсу креатиніну, закреп, діарея, набряки, алопецію, підвищений рівень креатиніну, висипання/свербіж, зниження рівня тромбоцитів, лихоманку (без нейтропенії), захворювання очей (включно з кон'юнктивітом), підвищену сльозотечу, зниження рівня клубочкової фільтрації, запаморочення і рухова нейропатія.
Клінічно значуща токсичність, яка спостерігалася в < 1 % пацієнтів (рідко), відібраних випадковим шляхом для терапії пеметрекседом, включає: лихоманку, нейгропенію, фебрильну нейтропенію, алергічні реакції/гіперчутливість, рухову нейропатію, мультиформпу еритему, ниркову недостатність, надшлуночкову аритмію, емболію легеневої артерії.
Безпека застосування оцінювалася в пацієнтів, відібраних випадковим шляхом для терапії пеметрекседом. Частота виникнення побічних реакцій оцінювалась у пацієнтів, які отримали < 6 циклів підтримуючого лікування пеметрекседом, порівняно з пацієнтами, які отримали > 6 циклів лікування пеметрекседом. Підвищення частоти виникнення побічних реакцій (всіх ступенів тяжкості) спостерігалося зі збільшенням тривалості застосування. Значне підвищення частоти виникнення побічного явища, можливо пов'язаного із застосуванням лікарського засобу, у вигляді нейтропенії 3-го або 4-го ступеня спостерігалося зі збільшенням тривалості застосування пеметрекседу (< 6 циклів: - 3,3 %; > 6 циклів: - 6,4 %; р = 0,046). Не спостерігалося статистично значущої різниці в частоті виникнення інших окремих побічних явищ 3-го, 4-го та 5-го ступенів зі збільшенням тривалості застосування.
Про серйозні кардіоваскулярні та цереброваскулярні події, включаючи інфаркт міокарда, стенокардію, порушення мозкового кровообігу та транзиторну ішемічну атаку, повідомлялося нечасто у ході клінічних досліджень пеметрекседу, звичайно у разі комбінації з іншими цитотоксичними агентами. Більшість пацієнтів, у яких були зареєстровані такі випадки, мали фактори кардіоваскулярного ризику в анамнезі.
У ході клінічних досліджень про випадки сепсису, іноді летальні, повідомлялося приблизно у 1 % пацієнтів.
Про випадки езофагіту повідомлялося нечасто в процесі клінічних досліджень пеметрекседу. Про випадки панцитопенії нечасто повідомлялося у ході клінічних досліджень пеметрекседу. У ході клінічних досліджень нечасто повідомлялося про випадки колітів (включаючи кишкові та ректальні кровотечі, іноді летальні, кишкові перфорації, кишкові некрози та запалення сліпої кишки) у пацієнтів, які лікувалися пеметрекседом.
У ході клінічних досліджень нечасто повідомлялося про випадки інтерстиціального пневмоніту з респіраторною недостатністю, іноді летальною, у пацієнтів, які лікувалися пеметрскседом.
Дані постмаркетингових досліджень:
Розлади з боку шлунково-кишкового тракту
У процесі клінічних досліджень нечасто повідомлялося про випадки колітів у пацієнтів, які лікувалися пеметрекседом.
Розлади з боку нирок
Нечасто повідомлялося про випадки гострої ниркової недостатності як при монотерапії пеметрекседом, так і при комбінованій терапії з іншими хіміотерапевтичними препаратами.
З боку системи дихання
Нечасто повідомлялося про випадки радіаційного пневмоніту у пацієнтів, які отримували радіаційну терапію до, під час чи після лікування пеметрекседом.
Реакції з боку імунної системи
Рідко повідомлялося про випадки анафілактичного шоку.
Загальні порушення та місцеві ускладнення в місці введення препарату
Про випадки набряків у пацієнтів, які отримували лікування пеметрекседом, повідомлялося нечасто.
Травми, отруєння, ускладнення
Рідко повідомлялося про випадки
«радіаційної пам'яті» у пацієнтів, які раніше отримували радіаційну терапію.
Нечасто повідомлялося про випадки периферичної ішемії, що часом призводила до некрозу кінцівки.
Шкірні реакції
Рідко повідомлялося про бульозні стани, в т. ч. синдром Стівенса-Джонсона та токсичний епідермальний некроліз, які в окремих випадках були летальні. З невідомою частотою повідомлялося про розвиток ексудативної еритеми переважно нижніх кінцівок.
Порушення з боку крові та лімфатичної системи
Рідко повідомлялося про імуноопосередковану гемолітичну анемію в пацієнтів, які отримували пеметрексед.
Гепапюбіліарні розлади
У процесі клінічних досліджень рідко повідомлялося про випадки потенційно серйозних гепатитів у пацієнтів, які отримували пеметрексед.
Термін придатності Каржест
Для 100 мг - 3 роки. Для 500 мг - 2 роки.
Умови зберігання Каржест
Зберігати при температурі не вище 25 °С. Зберігати у недоступному для дітей місці.
Несумісність
Пеметрексед фізично несумісний з розчинниками, що містять кальцій, зокрема з розчином Рінгера і лактатом Рінгера. Сумісність пеметрекседу з іншими препаратами і розчинниками не досліджувалася, тому його не рекомендується змішувати з будь-яким іншим препаратом.
Упаковка
1 флакон з порошком у картонній коробці.
Категорія відпуску
За рецептом.
Виробник
Д-р Редді’с Лабораторіє Лтд (Виробничий відділ - 7).
Місцезнаходження виробника
Дільниця № Р1-Р9, Фаза - III, ВСЕЗ, Дювада, Візакхапатнам Дистрикт, Аидра Прадеш, Індія.
Подальша інформація
Пам'ятайте, зберігайте ці та всі інші ліки в недоступному для дітей місці, ніколи не передавайте свої ліки іншим і використовуйте Каржест тільки за призначенням.
Завжди консультуйтеся зі своїм лікарем, щоб переконатися, що інформація, яка відображається на цій сторінці, може бути застосована до ваших особистих обставин.
Увага! Ця інструкція для медичного застосування лікарського засобу є офіційною інструкцією виробника ТОВ «Др. Редді’с Лабораторіз».
Авторське право:
- http://www.drreddys.ua - ТОВ «Др. Редді’с Лабораторіз»
- http://www.drlz.com.ua - Державний реєстр ЛЗ України
| Тип даних | Відомості з реєстру |
| Торгівельне найменування: | Каржест |
| Виробник: | ТОВ «Др. Редді’с Лабораторіз» |
| Форма випуску: | порошок ліофілізований для приготування концентрату для розчину для інфузій по 100 мг або 500 мг, 1 флакон з порошком у картонній коробці |
| Реєстраційне посвідчення: | UA/17294/01/01, UA/17294/01/02 |
| Дата початку: | 05.03.2019 |
| Дата закінчення: | 03.05.2024 |
| Міжнародне непатентоване найменування: | Pemetrexed |
| Умови відпуску: | за рецептом |
| Склад: | 1 флакон містить 100 мг або 500 мг пеметрекседу (у вигляді пеметрекседу динатрію) |
| Фармакотерапевтична група: | Антиметаболіти. Структурні аналоги фолієвої кислоти. |
| Код АТС: | L01BA04 |
| Заявник: | ТОВ «Др. Редді’с Лабораторіз» |
| Країна заявника: | Індія |
| Адреса заявника: | 8-2-337, Роуд №3, Банджара Хіллз, Хайдерабад, Телангана - 500 034, Індія |
| Тип ЛЗ: | Звичайний |
| ЛЗ біологічного походження: | Нi |
| ЛЗ рослинного походження: | Нi |
| Гомеопатичний ЛЗ: | Нi |
| Тип МНН: | Моно |
| Дострокове припинення | Нi |
| Код ATC | Назва групи |
| L | Антинеопластичні та імуномодулюючі засоби |
| L01 | Протипухлинні препарати |
| L01B | Антиметаболіти |
| L01BA | Структурні аналоги фолієвої кислоти |
| L01BA04 | Пеметрексед |

