- Общая характеристика
- МНН
- Описание
- Состав
- Форма выпуска
- Фармакотерапевтическая группа
- Фармакологические свойства
- Показания к применению
- Способ применения и дозировка
- Побочные действия
- Противопоказания
- Передозировка
- Меры предосторожности
- Дети
- Период беременности
- Управление автомобилем
- Взаимодействие
- Условия и срок хранения
- Упаковка
- Правила отпуска
- Информация о производителе
Актемра инструкция по применению
Официальная инструкция лекарственного препарата Актемра раствор 162мг/0,9мл. Описание и применение Aktemra, аналоги и отзывы. Инструкция Актемра раствор утвержденная компанией производителем.
Общая характеристика
Международное непатентованное наименование
Tocilizumab.
Описание
От бесцветного до слегка желтоватого цвета жидкость.
Состав лекарственного средства
В каждом 0,9 мл раствора шприц-тюбика содержится 162 мг тоцилизумаба.
Перечень вспомогательных веществ:
L-гистидин
L-гистидина гидрохлорида моногидрат
L-аргинин
L-аргинина гидрохлорид
L-метионин
Полисорбат 80
Вода для инъекций.
Форма выпуска
Раствор для подкожного введения 162 мг/0,9 мл.
Фармакотерапевтическая группа
Иммунодепрессанты, ингибиторы интерлейкина.
Код АТС: L04AC07/
Фармакологические свойства
Тоцилизумаб — это рекомбинантное гуманизированное моноклинальное антитело подкласса иммуноглобулинов G1 (IgG1) к растворимым и мембранным рецепторам интерлейкина 6 (ИЛ6). Полный перечень вспомогательных веществ смотрите в разделе «Перечень вспомогательных веществ».
Фармакодинамические свойства
Механизм действия
Препарат Актемра® специфически связывается как с растворимыми, так и с мембранными рецепторами ИЛ-6 (sIL-6R и mIL-6R). Было показано, что тоцилизумаб обладает способностью подавлять сигналы медиаторов sIL-6R и mIL-6R. ИЛ-6 является плейотропным провоспалительным цитокином, вырабатываемым различными типами клеток, в том числе T- и B-клетками, моноцитами и фибробластами. ИЛ-6 участвует в различных физиологических процессах, таких как Т-клеточная активация, индукция секреции иммуноглобулина, начало печеночного синтеза белков острой фазы и стимуляция гемопоэза. ИЛ-6 вовлечен в патогенез таких заболеваний, как воспалительные заболевания, остеопороз и новообразования.
Фармакодинамическое действие
В клинических исследованиях с препаратом Актемра® у пациентов наблюдалось быстрое снижение уровня С-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ) и содержания сывороточного амилоида А (САА). Как следствие воздействия на острофазовые показатели, применение препарата Актемра® ассоциировалось со снижением числа тромбоцитов в пределах нормальных значений. Наблюдалось повышение уровня гемоглобина за счет ослабления препаратом Актемра® отрицательных эффектов ИЛ-6 на образование гепсидина, способствующего повышению уровня железа. Применение препарата Актемра® приводило к снижению уровня СРБ до нормальных значений уже на 2 неделе терапии, при этом данное снижение сохранялось во время всего лечения.
В клиническом исследовании ГКА WA28119 наблюдалось аналогичное быстрое снижение уровня С-реактивного белка (СРБ) и скорости оседания эритроцитов (СОЭ) наряду с небольшим увеличением среднего содержания гемоглобина в эритроцитах. У здоровых добровольцев введение препарата Актемра® в дозах от 2 до 28 мг/кг внутривенно и от 81 до 162 мг подкожно приводило к снижению абсолютного количества нейтрофилов до самого низкого уровня на 2—5 дни применения. В дальнейшем уровень нейтрофилов возвращался к исходному значению дозозависимым образом. У пациентов было продемонстрировано аналогичное (в сравнении со здоровыми добровольцами) снижение абсолютного числа нейтрофилов после введения препарата Актемра® (смотрите раздел «Нежелательные реакции»).
РА
Внутривенное введение
Клиническая эффективность
Эффективность тоцилизумаба по уменьшению признаков и симптомов РА оценивалась в 5 рандомизированных, двойных слепых, многоцентровых исследованиях. Исследования I—V включали пациентов в возрасте 18 лет и старше с установленным активным РА по критериям Американской коллегии ревматологов (АКР), у которых до лечения было не менее 8 болезненных и 6 опухших суставов. В исследовании I препарата Актемра® вводили внутривенно каждые четыре недели в качестве монотерапии. В исследованиях II, III и V препарат Актемра® вводили внутривенно каждые четыре недели в комбинации с МТ в сравнении с комбинацией плацебо и МТ. В исследовании IV препарат Актемра вводили внутривенно каждые 4 недели в комбинации с другими БПВП в сравнении с комбинацией плацебо и других БПВП. Первичной конечной точкой для каждого из 5 исследований являлась доля пациентов с ответом АКР20 к 24 неделе исследования.
В исследовании I оценивали состояние 673 пациентов, которые не получали МТ в течение шести месяцев до рандомизации и которые не прекращали предшествующее лечение МТ в связи с клинически значимыми токсическими эффектами или отсутствием ответа. Большинство пациентов (67 %) ранее не получало МТ. Препарат Актемра® назначали в виде монотерапии в дозе 8 мг/кг каждые четыре недели. Группа сравнения получала МТ еженедельно (на протяжении 8-недельного периода дозу еженедельно титровали с 7,5 мг до максимальной в 20 мг).
В исследовании II, двухгодичном с плановыми анализами на 24, 52 и 104 неделе, оценивали состояние 1196 пациентов с неадекватным клиническим ответом на применение МТ. Препарат Актемра® в дозе 4 или 8 мг/кг или плацебо давали каждые четыре недели в качестве «слепой терапии» на протяжении 52 недель в комбинации с неизменными дозами МТ (10—25 мг еженедельно). После 52 недели все пациенты могли получать открытое лечение препаратом Актемра® в дозе 8 мг/кг. Из числа тех пациентов, которые завершили исследование и изначально были рандомизированы в группу плацебо и МТ, 86 % получало открытое лечение препаратом Актемра® в дозе 8 мг/кг через 2 года. Первичной конечной точкой являлась доля пациентов с ответом АКР20 на 24 неделе исследования. На 52 и 104 неделе исследования сопервичными конечными точками были предотвращение деструкции суставов и улучшение их функции.
В исследовании III оценивали состояние 623 пациентов с неадекватным клиническим ответом на МТ. Препарат Актемра® в дозе 4 или 8 мг/кг или плацебо вводились каждые четыре недели в комбинации с неизменными дозами МТ (10—25 мг еженедельно).
В исследовании IV оценивали состояние 1220 пациентов с неадекватным ответом на текущую терапию ревматологического заболевания, в том числе на лечение одним или более БПВП. Препарат Актемра® в дозе 8 мг/кг или плацебо вводили каждые четыре недели в комбинации с неизменными дозами БПВП.
В исследовании V оценивали состояние 499 пациентов с неадекватным клиническим ответом на терапию одним или более антагонистами ФНО либо с непереносимостью таковых. Перед рандомизацией терапию антагонистом ФНО отменяли. Тоцилизумаб в дозе 4 или 8 мг/кг или плацебо применяли каждые четыре недели в комбинации с неизменными дозами МТ (10—25 мг еженедельно)
Клинический ответ
Во всех исследованиях на 6 месяце лечения у пациентов, получавших лечение препаратом Актемра® в дозе 8 мг/кг, была статистически значимая более высокая частота ответов АКР20, 50 и 70, чем в контрольной группе (таблица 2). В исследовании I было показано преимущество препарата Актемра® в дозе 8 мг/кг над активным препаратом сравнения МТ.
Эффективность лечения была схожей и не зависела от наличия или отсутствия ревматоидного фактора, возраста, пола, расовой принадлежности, числа предшествующих курсов лечения или стадии заболевания. Ответ на терапию возникал быстро (уже на 2 неделе) и выраженность его продолжала расти с продлением лечения. Стойкий ответ наблюдался в дальнейшем на протяжении более 3 лет в продолжающихся открытых расширенных исследованиях I—V.
При лечении препаратом Актемра® в дозе 8 мг/кг существенные улучшения отмечались по всем компонентам ответа АКР, в том числе: число болезненных и опухших суставов; общая оценка пациентом и врачом; индекс нетрудоспособности; оценка боли и уровень СРБ в сравнении с таковыми у пациентов, получавших плацебо и МТ или другие БПВП во всех исследованиях.
У пациентов, принимавших участие в исследованиях I—V, в начале лечения индекс активности заболевания (DAS28) составлял 6,5—6,8. У пациентов, получавших лечение тоцилизумабом, в сравнении с исходным показателем наблюдалось значительное снижение DAS28 (среднее улучшение) на 3,1—3,4 по сравнению с пациентами контрольной группы (1,3—2,1). На 24 неделе терапии доля пациентов, достигших клинической ремиссии по DAS28 (DAS28 < 2,6), была значительно больше в группе тоцилизумаба (28—34 %), чем в контрольной группе (1—12 %). В исследовании II 65 % пациентов достигло DAS28 < 2,6 на 104 неделе терапии по сравнению с 48 % пациентов, достигших этого показателя на 52 неделе, и 33 % пациентов — на 24 неделе.
В сводном анализе результатов исследований II, III и IV доля пациентов, достигших ответа АКР20, 50 и 70 была значительно больше (59 % по сравнению с 50 %, 37 % по сравнению с 27 %, 18 % по сравнению с 11 %, соответственно) в группе, получавшей тоцилизумаб в дозе 8 мг/кг и БПВП, по сравнению с группой, получавшей тоцилизумаб в дозе 4 мг/кг и БПВП (р < 0,03).
Аналогично этому доля пациентов, достигших ремиссии DAS28 (DAS28 < 2,6) была значительно больше (31 %) по сравнению с 16 %, соответственно, среди пациентов, получавших препарат Актемра® в дозе 8 мг/кг и БПВП, чем среди пациентов, получавших препарат Актемра® в дозе 4 мг/кг и БПВП (р < 0,0001).
Таблица 2. Ответы АКР в плацебо-, МТ- или БПВП-контролируемых исследованиях (% пациентов).
| Исследование I «AMBITION» | Исследование II «LITHE» | Исследование III «OPTION» | Исследование IV «TOWARD» | Исследование V «RADIATE» | ||||||
| Неделя | TCZ 8 мг/кг | MT | TCZ 8 мг/кг + MT | РВО + MT | TCZ 8 мг/кг + MT | РВО + MT | TCZ 8 мг/кг + DMARD | РВО + DMARD | TCZ8 мг/кг + MT | РВО + MT |
| N = 286 | N = 284 | N = 398 | N = 393 | N = 205 | N = 204 | N = 803 | N = 413 | N=170 | N = 158 | |
| АКР20 | ||||||||||
| 24 | 70 % *** | 52 % | 56 % *** | 27 % | 59 % *** | 26 % | 61 % *** | 24 % | 50 % *** | 10 % |
| 52 | 56 % *** | 25 % | ||||||||
| АКР50 | ||||||||||
| 24 | 44 % ** | 33 % | 32 % *** | 10 % | 44 % *** | 11 % | 38 % *** | 9 % | 29 % *** | 4 % |
| 52 | 36 % *** | 10 % | ||||||||
| AKP70 | ||||||||||
| 24 | 28 % ** | 15 % | 13 % *** | 2 % | 22 % *** | 2 % | 21 % *** | 3 % | 12 % ** | 1 % |
| 52 | 20 % *** | 4 % | ||||||||
TCZ — тоцилизумаб
МТ — метотрексат
РВО — плацебо
DMARD — базисный противовоспалительный препарат
** р≤0,001, TCZ по сравнению с PBO+MT/DMARD
***р<0,0001, TCZ по сравнению с PBO+MT/DMARD
Хороший клинический ответ
Через 2 года лечения тоцилизумабом в комбинации с МТ 14 % пациентов достигло хорошего клинического ответа (ответ АКР70 сохранялся на протяжении 24 недель или более).
Рентгенологический ответ
В исследовании II у пациентов с неадекватным ответом на лечение МТ проводилась рентгенологическая оценка торможения деструкции суставов, которая была выражена как изменение модифицированного индекса Шарпа и его компонентов, индекса эрозирования и индекса сужения суставной щели. По сравнению с контрольной группой у пациентов, получавших препарат Актемра®, было показано торможение деструкции суставов со значительно меньшим рентгенологическим прогрессированием (таблица 3).
В открытом расширенном периоде исследования II у пациентов, получавших лечение тоцилизумабом в комбинации с МТ, торможение прогрессирования деструкции суставов сохранялось на втором году лечения. На 104 неделе терапии среднее значение суммарного индекса Шарпа-Генанта по сравнению с исходным было значительно ниже у пациентов, рандомизированных в группу тоцилизумаба в дозе 8 мг/кг в комбинации с МТ (р < 0,0001), по сравнению с пациентами, рандомизированными в группу плацебо в комбинации с МТ.
Таблица 3. Средние показатели рентгенологических изменений за 52 недели исследованияII.
| РВО + MTX(+ TCZ с 24 недели)N = 393 | TCZ 8 мг/кг + MTX N = 398 | |
| Суммарный индекс Шарпа-Генанта | 1,13 | 0,29* |
| Индекс эрозирования | 0,71 | 0,17* |
| Индекс сужения суставной щели | 0,42 | 0,12** |
РВО — плацебо
МТ — метотрексат
TCZ — тоцилизумаб
JSN — сужение суставной щели
* р ≤ 0,0001, TCZ по сравнению с РВО+МТ
** р < 0,005, TCZ по сравнению с РВО+МТ
После одного года лечения тоцилизумабом в комбинации с МТ у 85 % пациентов (n = 348) не было прогрессирования структурного повреждения суставов согласно изменению суммарного индекса Шарпа, равного 0 или менее, по сравнению с 67 % пациентов, получавших лечение плацебо и МТ (n = 290) (р < 0,001). Данный результат сохранялся на протяжении 2 лет лечения (83 %; n = 353). У девяноста трех процентов пациентов (93 %; n = 271) отсутствовало прогрессирование деструкции суставов между 52 и 104 неделями терапии.
Показатели качества жизни, связанного со здоровьем
Согласно анкетированию пациентов, применение препарата Актемра® привело к улучшению всех показателей по опроснику оценки состояния здоровья — HAQ-DI, по краткой форме-36 и опросникам функциональной оценки терапии хронических заболеваний. Статистически значимые улучшения индекса HAQ-DI наблюдались у пациентов, получавших лечение препаратом Актемра®, по сравнению с пациентами, получавшими лечение БПВП. Во время открытого периода исследования II улучшение физического состояния сохранялось в течение 2 лет. На 52 неделе среднее изменение индекса HAQ-DI составляло -0,58 в группе препарата Актемра® 8 мг/кг и МТ по сравнению с -0,39 в группе плацебо и МТ. На 104 неделе среднее изменение индекса HAQ-DI сохранялось в группе препарата Актемра® 8 мг/кг и МТ (-0,61).
Уровень гемоглобина
Наблюдались статистически значимые улучшения уровня гемоглобина на 24 неделе терапии при применении препарата Актемра® по сравнению с БПВП (р < 0,0001). Средний уровень гемоглобина повышался ко 2 неделе и оставался в пределах нормы в течение всех 24 недель.
Монотерапия тоцилизумабом по сравнению с монотерапией адалимумабом
В исследовании WA19924, 24-недельном двойном слепом исследовании, сравнивали монотерапию препаратом Актемра® с монотерапией адалимумабом, и оценивали состояние 326 пациентов с РА с непереносимостью МТ, или когда продолжение лечения МТ считалось нецелесообразным (включая пациентов с неадекватным ответом на лечение МТ). Пациентам группы препарата Актемра® внутривенно (IV) вводили препарат Актемра® (8 мг/кг) каждые 4 недели и делали инъекции плацебо подкожно (SC) каждые 2 недели. Пациентам группы адалимумаба делали инъекции адалимумаба подкожно (40 мг) каждые 2 недели и вводили плацебо внутривенно каждые 4 недели. Наблюдалось статистически значимое превосходство в эффективности препарата Актемра® над адалимумабом по контролю активности заболевания к 24 неделе терапии по сравнению с исходными показателями, выраженное в изменении показателя первичной точки DAS28 и всех вторичных точек (таблица 4).
Таблица 4. Результаты эффективности в исследовании VI (WA19924).
| ADA+ плацебо (IV)N = 162 | TCZ + плацебо (SC)N = 163 | р-значение(а) | ||
| Первичная конечная точка — среднее изменение показателя к 24 неделе в сравнении с исходным | ||||
| DAS28 (скорректированная средняя величина) | -1,8 | -3,3 | ||
| Разница в скорректированной средней величине (95 % доверительный интервал (ДИ)) | -1,5 (-1,8, -1,1) | <0,0001 | ||
| Вторичные конечные точки — доля пациентов, ответивших на лечение к 24 неделе(b) | ||||
| DAS28 < 2,6, n (%) DAS28 < 3,2, n (%)Ответ АКР20, n (%)Ответ АКР50, n (%)Ответ АКР70, n (%) | 17 (10,5)32 (19,8)80 (49,4)45 (27,8)29(17,9) | 65 (39,9)84 (51,5) 106 (65,0)77 (47,2) 53 (32,5) | < 0,0001< 0,00010,00380,00020,0023 | |
(a) р-значение скорректировано по локализации и длительности РА для всех конечных точек и по дополнительной исходной оценке для всех постоянных конечных точек.
(b) Для отсутствующих данных использовался условный учет пациентов, не ответивших на лечение. Критерий множественных сравнений с поправкой Бонферрони-Хольма.
В целом, у тоцилизумаба и адалимумаба были схожие профили нежелательных явлений. Доли пациентов с серьезными нежелательными явлениями в группах лечения были сопоставимы (препарат Актемра® 11,7 % по сравнению с адалимумабом 9,9 %). Типы нежелательных реакций на препарат в группе препарата Актемра® были аналогичны имеющимся в профиле безопасности тоцилизумаба; о нежелательных реакциях на препарат сообщалось со схожей частотой, указанной в таблице 1. О повышенной частоте возникновения инфекций и инвазий сообщалось в группе препарата Актемра® (48 %) по сравнению с 42 %, при этом разницы в частоте возникновения серьезных инфекций (3,1 %) не было. Оба исследуемые препарата приводили к одинаковой картине изменений лабораторных показателей (снижение числа нейтрофилов и тромбоцитов, повышение активности АЛТ, ACT и уровня липидов); однако значимость изменений и частота отмеченных отклонений была выше в группе препарата Актемра®. У четверых пациентов (2,5 %) группы препарата Актемра® и двоих (1,2 %) группы адалимумаба имело место снижение числа нейтрофилов 3 или 4 степени по шкале критериев общей токсичности (СТС). У одиннадцати пациентов (6,8 %) группы препарата Актемра® и пяти (3,1 %) из группы адалимумаба отмечено повышение активности АЛТ 2 степени или выше по шкале СТС. Повышение показателя ЛПНП по сравнению с исходным, в среднем, составило 0,64 ммоль/л (25 мг/дл) у пациентов из группы препарата Актемра® и 0,19 ммоль/л (7 мг/дл) у пациентов группы адалимумаба. Данные по безопасности в группе препарата Актемра® соответствовали таковым, указанным в имеющемся профиле по безопасности препарата Актемра®, и новых или неожиданных нежелательных реакций на препарат не наблюдалось (смотрите таблицу 1).
Подкожное введение
Клиническая эффективность
Эффективность подкожного введения препарата Актемра® по уменьшение признаков и симптомов РА и рентгенологическому ответу оценивалась в 2 рандомизированных, двойных слепых, контролируемых, многоцентровых исследованиях. Исследование I (SC-I) включало пациентов в возрасте старше 18 лет, с активным РА умеренной или тяжелой степени по критериям АКР, у которых до лечения было не менее 4 болезненных и 4 опухших сустава. Все пациенты получали фоновую терапию небиологическим(и) БПВП. Исследование II (SC-II) включало пациентов старше 18 лет с активным РА умеренной или тяжелой степени по критериям АКР, у которых до лечения было не менее 8 болезненных и 6 опухших суставов.
Переход с лекарственной формы для внутривенных инфузий в дозе 8 мг/кг один раз в 4 недели на лекарственную форму для подкожных инъекций в дозе 162 мг один раз в неделю будет способствовать изменению концентрации препарата. Уровень концентрации изменяется в зависимости от массы тела пациента (выше у пациентов с небольшой массой тела и ниже у пациентов с большой массой тела), но клинический результат сопоставим с таковым, полученным при лечении препаратом внутривенно.
Клинический ответ
В исследовании SC-I оценивали состояние пациентов с активным РА умеренной или тяжелой степени, с неадекватным ответом на текущую терапию ревматологического заболевания, в том числе на лечение одним или более БПВП, при этом приблизительно у 20 % пациентов в анамнезе был неадекватный ответ как минимум на один ингибитор ФНО. В исследовании SC-I 1262 пациента было рандомизировано в соотношении 1:1 на группы, которые в комбинации с небиологическим(и) БПВП получали препарат Актемра® в дозе 162 мг подкожно один раз в неделю или 8 мг/кг внутривенно один раз в 4 недели. Первичной конечной точкой данного исследования являлась доля пациентов с ответом АКР20 к 24 неделе исследования. Результаты исследования SC-I представлены в таблице 5.
Таблица 5. Ответы АКР к 24 неделе исследования SC-I (% пациентов).
| SC-Ia | ||
| TCZ SC 162 мг один раз в неделю + DMARDN=558 | TCZ IV 8 мг/кг + DMARDN=537 | |
| АКР20 к 24 неделе | 69,4 % | 73,4 % |
| Взвешенная разность (95 % доверительный интервал (ДИ)) | -4,0 (-9,2, 1,2) | |
| АКР50 к 24 неделе | 47,0 % | 48,6 % |
| Взвешенная разность (95 % доверительный интервал (ДИ)) | -1,8 (-7,5, 4,0) | |
| АКР70 на 24 неделе | 24,0 % | 27,9 % |
| Взвешенная разность (95 % доверительный интервал (ДИ)) | -3,8 (-9,0, 1,3) | |
TCZ — тоцилизумаб
а популяция по протоколу
В начале лечения в исследовании SC-I DAS28 составлял 6,6 в группе подкожного введения препарата и 6,7 в группе внутривенного введения препарата. К 24 неделе терапии в обеих группах наблюдалось значительное снижение DAS28 (среднее улучшение) на 3,5 по сравнению с исходными показателями; сопоставимая доля пациентов достигла клинической ремиссии DAS28 (DAS28 < 2,6) в группе подкожного введения препарата (38,4 %) и в группе внутривенного введения препарата (36,9 %).
Рентгенологический ответ
Рентгенологический ответ при подкожном введении препарата Актемра® оценивали в двойном слепом, контролируемом, многоцентровом исследовании у пациентов с активным РА (SC-II). В исследовании SC-II оценивали состояние пациентов с активным РА умеренной или тяжелой степени, у которых был неадекватный ответ на текущую терапию ревматологического заболевания, в том числе на лечение одним или более БПВП, при этом приблизительно у 20 % пациентов в анамнезе был неадекватный ответ как минимум на один ингибитор ФНО. Исследование включало пациентов в возрасте старше 18 лет с активным РА умеренной или тяжелой степени по критериям АКР, у которых до лечения было не менее 8 болезненных и 6 опухших суставов. В исследовании SC-II 656 пациентов было рандомизировано в соотношении 2:1 на группы препарата Актемра® 162 мг подкожно один раз в две недели или плацебо, в комбинации с небиологическим(и) БПВП.
В исследовании SC-II проводилась рентгенологическая оценка задержки структурного повреждения суставов, выраженная как изменение по сравнению с исходными показателями модифицированного ван дер Хайде среднего суммарного индекса Шарпа (мСИШ). К 24 неделе было показано торможение структурного повреждения суставов со значительно меньшим рентгенологическим прогрессированием у пациентов, получавших препарат Актемра® подкожно, по сравнению с пациентами группы плацебо (средний мСИШ — 0,62 по сравнению с 1,23, р = 0,0149 (ван Эльтерен)). Эти результаты соответствуют тем, что наблюдались у пациентов при введении тоцилизумаба внутривенно. В исследовании SC-II у пациентов, получавших лечение препаратом Актемра® подкожно один раз в две недели, на 24 неделе АКР20 составлял 60,9 %, АКР50 — 39,8 % и АКР70 — 19,7 %, по сравнению с АКР20 — 31,5 %, АКР50 — 12,3 % и АКР70 — 5,0 % у пациентов группы плацебо.
У пациентов в начале лечения среднее значение DAS28 составляло 6,7 в группе подкожного введения препарата и 6,6 в группе плацебо. К 24 неделе терапии наблюдалось значительное снижение DAS28 по сравнению с исходными показателями: на 3,1 в группе подкожного введения препарата и на 1,7 в группе плацебо; DAS28 < 2,6 наблюдался у 32,0 % пациентов в группе подкожного введения препарата и у 4,0 % пациентов в группе плацебо.
Показатели качества жизни, связанного со здоровьем
В исследовании SC-I к 24 неделе снижение по HAQ-DI в среднем составляло 0,6 от исходного как в группе подкожного, так и в группе внутривенного применения препарата. Доля пациентов, достигших клинически значимого улучшения по HAQ-DI на 24 неделе (изменение относительно исходного значения 0,3 единицы и больше), была сопоставима в группе подкожного применения препарата (65,2 %) и в группе внутривенного применения (67,4 %), при этом взвешенная разность между долями пациентов составляла —2,3 % (95 % ДИ — 8,1, 3,4). Согласно краткой форме-36 на 24 неделе среднее изменение индекса психического здоровья составило 6,22 в группе подкожного применения препарата и 6,54 в группе внутривенного применения препарата; и по индексу физического здоровья показатели были сходны — 9,49 в группе подкожного применения препарата и 9,65 в группе внутривенного применения препарата.
В исследовании SC-II к 24 неделе среднее снижение по HAQ-DI было значительно больше у пациентов, получавших лечение тоцилизумабом подкожно один раз в две недели (0,4), чем у получавших плацебо (0,3). Доля пациентов, достигших клинически значимого улучшения по HAQ-DI на 24 неделе (изменение относительно исходного значения 0,3 единицы и выше), была больше при подкожном применении препарата один раз в две недели (58 %), чем при применении плацебо (46,8 %). По данным краткой формы-36 (среднее изменение индексов психического и физического здоровья) показатели были значительно выше в группе подкожного применения тоцилизумаба (6,5 и 5,3), чем в группе плацебо (3,8 и 2,9).
ГКА
Подкожное введение
Клиническая эффективность
Исследование WA28119 было многоцентровым, рандомизированным, плацебо-контролируемым, двойным слепым, с параллельными группами, исследованием III фазы, которое проводилось с целью оценки эффективности и безопасности лекарственного средства Актемра® у пациентов с ГКА.
Двести пятьдесят один (251) пациент с впервые развившимся или рецидивирующим ГКА был набран в исследование и отнесен к одной из четырех терапевтических групп. Исследование состояло из 52-недельного слепого периода (часть 1), за которым следовала открытая фаза длительностью в 104 недели (часть 2). Цель части 2 заключалась в описании долгосрочной безопасности и эффективности после 52 недель лечения препаратом Актемра®, изучении частоты рецидивов и необходимости терапии лекарственным средством Актемра® по истечении 52 недель, а также установлении потенциального длительного стероид-сберегающего эффекта Актемра®.
Две подкожные дозы препарата Актемра® (162 мг каждую неделю и 162 мг один раз в две недели) сравнивались с двумя разными группами с контролем плацебо с рандомизацией 2:1:1:1.
Все пациенты получали фоновую терапию глюкокортикоидом (преднизоном). В каждой группе терапии Актемра® и в одной из групп плацебо использовался предварительно заданный режим приема преднизона в постепенно снижаемой дозе в течение 26 недель, а во второй группе плацебо использовался предварительно заданный режим приема преднизона в постепенно снижаемой дозе в течение 52 недель, что было запланировано с целью большего соответствия стандартной практике.
Длительность терапии глюкокортикоидом в ходе скрининга и до начала получения препарата Актемра® (или плацебо) была аналогична во всех 4 терапевтических группах (см. таблицу 6).
Таблица 6. Длительность терапии кортикостероидами во время скрининга в исследовании WA28119
| Плацебо + 26 недель преднизона в постепенно снижаемой дозеN = 50 | Плацебо + 52 недели преднизона в постепенно снижаемой дозеN = 51 | Актемра® 162 мг раз в неделю подкожно + 26 недель преднизона в постепенно снижаемой дозеN = 100 | Актемра® 162 мг раз в две недели подкожно + 26 недель преднизона в постепенно снижаемой дозеN = 49 | |
| Длительность (дни) | ||||
| Среднее (стандартное отклонение (SD))СрединноеМин — макс | 35,7 (11,5)42,0 6—63 | 36,3 (12,5)41,0 12—82 | 35,6 (13,2)41,0 1—87 | 37,4 (14,4)42,0 9—87 |
Первичная конечная точка эффективности, проанализированная на основании части пациентов, достигающих устойчивой ремиссии без стероидов на неделе 52 при получении лекарственного средства Актемра® плюс 26 недель приема преднизона в постепенно снижаемой дозе, в сравнении с плацебо плюс 26 недель приема преднизона в постепенно снижаемой дозе была достигнута (таблица 7).
Ключевая вторичная точка эффективности, также основанная на части пациентов, достигающих устойчивой ремиссии на неделе 52, в сравнении с тоцилизумабом плюс 26 недель приема преднизона и с плацебо плюс 52 недели приема преднизона в постепенно снижаемой дозе также была достигнута (таблица 7).
Статистически значимый, существенно превосходящий терапевтический эффект наблюдался у препарата Актемра® по сравнению с плацебо в отношении достижения устойчивой ремиссии без стероидов на неделе 52 при получении лекарственного средства Актемра® плюс 26 недель приема преднизона в постепенно снижаемой дозе в сравнении с плацебо плюс 26 недель приема преднизона в постепенно снижаемой дозе и с плацебо плюс 52 недели приема преднизона в постепенно снижаемой дозе.
Процентное количество пациентов, достигающих устойчивой ремиссии на неделе 52, показано в таблице 7.
Вторичные конечные точки
Оценка времени до первого обострения ГКА показала значительно более низкий риск обострения в группе подкожного введения препарата Актемра® раз в неделю в сравнении с группой плацебо плюс 26 недель приема преднизона и группой плацебо плюс 52 недели приема преднизона в постепенно снижаемой дозе, а также в группе подкожного введения препарата Актемра® раз в две недели в сравнении с группой приема плацебо плюс 26 недель приема преднизона (если сравнивать при уровне значимости в 0,01). Использование подкожной дозы Актемра® раз в неделю также продемонстрировало клинически значимое снижение риска обострения в сравнении с группой приема плацебо плюс 26 недель приема преднизона среди пациентов, включенных в исследование с рецидивирующим ГКА, а также пациентов с впервые развившимся заболеванием (таблица 7).
Общая доза глюкокортикоидов
Общая доза преднизона на неделе 52 была значительно ниже в двух группах терапии Актемра® в сравнении с двумя группами плацебо (таблица 6). В отдельном анализе пациентов, получавших преднизон для лечения обострения ГКА в течение первых 52 недель, общая доза преднизона различалась значительно. Средние дозы преднизона для пациентов в группе терапии Актемра® раз в неделю и раз в две недели, составляли 3129,75 мг и 3847 мг соответственно. Обе были значительно ниже, чем в группах плацебо плюс 26 недель и плацебо плюс 52 недели приема преднизона в постепенно снижаемой дозе, т. е. 4023,5 мг и 5389,5 мг соответственно.
Таблица 7. Результаты по эффективности из исследования WA28119
| Плацебо + 26 недель преднизона в постепенно снижаемой дозеN=50 | Плацебо + 52 недели преднизона в постепенно снижаемой дозе N=51 | Актемра® 162 мг раз в неделю подкожно + 26 недель преднизона в постепенно снижаемой дозеN=100 | Актемра® 162 мг раз в две недели подкожно + 26 недель преднизона в постепенно снижаемой дозеN=49 | ||||
| Первичная конечная точка | |||||||
| **** Устойчивая ремиссия (группы приема тоцилизумаба в сравнении с плацебо+26) | |||||||
| Пациенты с ответом на неделе 52, n (%) Не скорректированное различие в пропорциях (99,5 % CI) | 7(14 %)N/A | 9 (17,6 %)N/A | 56 (56 %)42 % *(18,00, 66,00) | 26 (53,1 %)39,06 % *(12,46, 65,66) | |||
| Ключевая вторичная конечная точка | |||||||
| Устойчивая ремиссия (группы приема тоцилизумаба в сравнении с плацебо+52) | |||||||
| Пациенты с ответом на неделе 52, n (%) Не скорректированное различие в пропорциях ё(99,5 % CI) | 7 (14 %)N/A | 9 (17,6 %)N/A | 56 (56 %)38,35 % *(17,89, 58,81) | 26 (53,1 %)35,41 %**(10,41, 60,41) | |||
| Другие вторичные конечные точки | |||||||
| Время до первого обострения ГКА1 (группы приема тоцилизумаба в сравнении с плацебо+26)HR (99 % CI)Время до первого обострения ГКА1 (группы приема тоцилизумаба в сравнении с плацебо+52)HR (99 % CI)Время до первого обострения ГКА1 (пациенты с рецидивом; группы приема тоцилизумаба в сравнении с плацебо+26) HR (99 % CI)Время до первого обострения ГКА1 (пациенты с рецидивом; группы приема тоцилизумаба в сравнении с плацебо+52) HR (99 % CI)Время до первого обострения ГКА1 (пациенты с впервые развившимся заболеванием; группы приема тоцилизумаба в сравнении с плацебо+26) HR (99 % CI)Время до первого обострения ГКА1 (пациенты с впервые развившимся заболеванием; группы приема тоцилизумаба в сравнении с плацебо+52) HR (99 % CI) Общая доза глюкокортикоидов (мг)Средняя на неделе 52 (группы приема тоцилизумаба в сравнении с плацебо+262)Средняя на неделе 52 (группы приема тоцилизумаба в сравнении с плацебо+522) | N/AN/AN/A N/AN/A N/A3296,00N/A | N/AN/AN/A N/AN/A N/AN/A 3817,50 | 0,23* (0.11, 0,46)0,39** (0,18, 0,82)0,23*** (0,09, 0,61)0,36 (0,13, 1,00)0,25*** (0,09, 0,70)0,44 (0,14, 1,32)1862,00*1862,00* | 0,28** (0,12, 0,66)0,48 (0,20, 1,16)0,42 (0,14, 1,28)0,67 (0,21, 2,10)0,20*** (0,05, 0,76)0,35 (0,09, 1,42)1862,00*1862,00* | |||
| Эксплоративные конечные точки | |||||||
| Среднегодовая частота рецидивов, неделя 52§Среднее (SD) | 1,74 (2,18) | 1,30 (1,84) | 0,41 (0,78) | 0,67 (1,10) | |||
* р < 0,0001
** р < 0,005 (пороговое значение для значимости первичного и ключевого вторичного испытания превосходства)
*** Описательное значение р < 0,005
****Обострение: повторное появление признаков или симптомов ГКА и/или СОЭ ≥ 30 мм/ч — необходимо увеличение дозы преднизона
Ремиссия: отсутствие обострения и нормализация уровня CRP
Устойчивая ремиссия: ремиссия с недели 12 до недели 52 — пациенты обязаны соблюдать указанную в протоколе дозу преднизона с постепенным снижением
1 анализ времени (в днях) от клинической ремиссии до первого обострения заболевания
2 р-значения определяются с использованием анализа ван Элтерена для непараметрических данных
§ статистический анализ не проводился
N/A= не применимо
HR = отношение рисков
CI = доверительный интервал
Показатели качества жизни
В исследовании WA28119 результаты из опросника SF-36 были разделены на сводные результаты по физическому и психологическому компонентам (PCS и MCS соответственно). Среднее изменение PCS от базового уровня к неделе 52 было выше (демонстрируя большее улучшение) в группах получения препарата Актемра® раз в неделю и раз в две недели [4,10, 2,76 соответственно], чем в двух группах плацебо [плацебо плюс 26 недель; -0,28, плацебо плюс 52 недели; -1,49], хотя только сравнение группы получения препарата Актемра® раз в неделю плюс 26 недель приема преднизона в постепенно снижаемой дозе и группы плацебо плюс 52 недели приема преднизона в постепенно снижаемой дозе (5,59, 99 % CI: 8,6, 10,32) показало статистически значимое различие (р = 0,0024). Для MCS среднее изменение от базового уровня к неделе 52 в группах получения лекарственного средства Актемра® раз в неделю и раз в две недели [7,28, 6,12 соответственно] было больше, чем в группе плацебо плюс 52 недели приема преднизона в постепенно снижаемой дозе [2,84] (хотя различия не были статистически существенными [раз в неделю р = 0,0252 для раза в неделю, р = 0,1468 для раза в две недели]), и аналогично группе плацебо плюс 26 недель приема преднизона в постепенно снижаемой дозе [6,67].
Общая оценка пациентом активности заболевания проводилась по визуальной аналоговой шкале (VAS) 0—100 мм. Среднее изменение значения общей оценки пациентом по шкале VAS от базового уровня к 52 неделе было меньше (демонстрируя большее улучшение) в группах приема лекарственного средства Актемра® раз в неделю и раз в две недели [-19,0, -25,3 соответственно], чем в обеих группах плацебо [плацебо плюс 26 недель -3,4, плацебо плюс 52 недели -7,2], хотя только в группе получения препарата Актемра® раз в две недели плюс 26 недель приема преднизона в постепенно снижаемой дозе было показано статистически значимое различие по сравнению с плацебо [плацебо плюс 26 недель в постепенно снижаемой дозе р = 0,0059, и плацебо плюс 52 недели в постепенно снижаемой дозе р = 0,0081].
Изменения в показателе слабости по Опроснику для функциональной оценки лечения хронического заболевания (FACIT) от базового уровня к 52 неделе были рассчитаны для всех групп. Средние [SD] значения изменений были следующими: Актемра® раз в неделю плюс 26 недель — 5,61 [10,115], Актемра® раз в две недели плюс 26 недель — 1,81 [80836], плацебо плюс 26 недель — 0,26 [10,702] и плацебо плюс 52 недели — -1,63 [6,753].
Изменение показателей по Европейскому опроснику качества жизни (EQ-5D) от базового уровня к 52 неделе были следующими: Актемра® раз в неделю плюс 26 недель — 0,10 [0,198], Актемра® раз в две недели плюс 26 недель — 0,05 [0,215], плацебо плюс 26 недель — 0,07 [0,293] и плацебо плюс 52 недели — -0,02 [0,159].
Более высокие показатели улучшения сигнала как по слабости в FACIT, так и по EQ5D.
Пациенты с пЮИА
52-недельное открытое многоцентровое исследование фармакокинетики (PK), фармакодинамики (PD) и безопасности было проведено при участии пациентов детского возраста с пЮИА в возрасте от 1 года до 17 лет с целью определить подходящую подкожную дозу лекарственного средства Актемра®, которая достигала сопоставимых профилей PK/PD и профилей безопасности при внутривенной схеме введения.
Подходящие пациенты получали дозы тоцилизумаба в зависимости от массы тела (BW), при этом пациенты с массой тела ≥30 кг (n = 25) получали дозу в 162 мг Актемра® каждые 2 недели (Q2W), а пациенты с массой тела менее 30 кг (n = 27) получали дозу в 162 мг Актемра® каждые 3 недели (Q3W) в течение 52 недель. Из этих 52 пациентов 37 (71 %) впервые получали лечение препаратом Актемра®, и 15 (29 %) получали в/в форму Актемра® IV и были переведены на п/к форму Актемра® на базовом уровне.
Схемы лечения п/к формами Актемра® в дозе 162 мг Q3W для пациентов с массой тела менее 30 кг и в дозе 162 мг Q2W для пациентов с массой тела ≥ 30 кг соответственно обеспечивают фармакокинетическое воздействие и фармакодинамический ответ для поддержания достигаемых в результате эффективности и безопасности, которые схожи с показателями, наблюдаемыми при использовании утвержденных схем в/в лечения препаратом Актемра® при пЮИА.
Результаты по поисковым показателям эффективности показали, что п/к форма Актемра® улучшала медиану индекса активности болезни при ювенильном артрите (JADAS)-71 у пациентов, впервые получавших Актемра®, и поддерживала медиану индекса JADAS-71 у пациентов, переведенных с в/в формы на п/к форму Актемра®, в течение всего периода исследования с участием пациентов из обеих групп, составленных по массе тела (менее 30 кг и ≥ 30 кг).
Европейское агентство лекарственных средств отозвало требование представлять результаты исследований применения препарата Актемра® в одной или более подгруппах детей с хроническим идиопатическим артритом (в том числе с ревматоидным артритом, анкилозирующим спондилитом, псориатическим артритом и ювенильным идиопатическим артритом). Информацию по применению препарата у детей смотрите в разделе «Режим дозирования и способ применения».
Фармакокинетические свойства
Фармакокинетика лекарственного средства Актемра® характеризуется нелинейным выведением, которое представлено комбинацией линейного клиренса и выведения по уравнению Михаэлиса — Ментен. Нелинейная часть выведения препарата Актемра® приводит к увеличению воздействия, которое больше, чем предполагается на основании дозы. Фармакокинетические параметры лекарственного средства Актемра® не меняются с течением времени. В связи с зависимостью общего клиренса от сывороточных концентраций Актемра® период полувыведения препарата Актемра® также зависит и варьирует от уровня концентрации в сыворотке крови. Популяционный фармакокинетический анализ в любой протестированной группе пациентов на данный момент не указывает на наличие взаимосвязи между кажущимся клиренсом и присутствием антител к препарату.
РА
Внутривенное введение
Фармакокинетику препарата Актемра® оценивали с использованием популяционного фармакокинетического анализа базы данных 1793 пациентов с РА, получавших препарата Актемра® в виде одночасовой инфузии в дозе 4 и 8 мг/кг каждые 4 недели на протяжении 24 недель. Следующие параметры (расчетная средняя ± стандартное отклонение (SD)) оценивались при введении препарата Актемра® в дозе 8 мг/кг каждые 4 недели: площадь под кривой «концентрация-время» (AUC) в равновесном состоянии = 35 000 ± 15 500 мкг∙ч/мл, минимальная остаточная концентрация (Cmin) = 9,74 ± 14,8 мкг/мл и максимальная концентрация (Cmax) = 183 ± 85,6 мкг/мл. Коэффициент кумуляции для AUC и Cmax был низким — 1,22 и 1,06, соответственно. Коэффициент кумуляции для Cmin был больше, как и ожидалось из-за нелинейного клиренса при более низких концентрациях. Равновесное состояние было достигнуто после первого введения для Cmax и через 8 и 20 недель — для AUC и Cmin, соответственно. Показатели AUC, Cmin и Cmax для препарата Актемра® возрастали при увеличении массы тела. При массе тела ≥ 100 кг расчетная средняя (± SD) AUC в равновесном состоянии, Cmin и Cmax препарата Актемра® составила 55 500 ± 14 100 мкг∙ч/мл, 19,0 ± 12,0 мкг/мл и 269 ± 57 мкг/мл, соответственно, что превышало средние значения концентрации в популяции пациентов (AUC = 35 000 ± 15 500 мкг∙ч/мл, Cmin = 9,74 ± 10,5 мкг/мл и Cmax = 183 ± 85,6 мкг/мл). Дозозависимая кривая препарата Актемра® уплощается при более высоких концентрациях, что приводит к меньшему приросту эффективности тоцилизумаба при каждом постепенном увеличении его концентрации, в результате чего у пациентов, получавших лечение препаратом Актемра® в дозе более 800 мг, клинически значимого увеличения эффективности продемонстрировано не было. Поэтому не рекомендуется увеличивать дозу препарата Актемра® выше 800 мг в одну инфузию (смотрите раздел «Режим дозирования и способ применения»).
Фармакокинетика лекарственного средства Актемра® у пациентов с пЮИА была охарактеризована при помощи популяционного фармакокинетического анализа, который включал в себя 237 пациентов, получавших лечение дозой в 8 мг/кг в/в каждые 4 недели (пациенты с массой тела ≥ 30 кг), 10 мг/кг в/в каждые 4 недели (пациенты с массой тела менее 30 кг), 162 мг п/к каждые 2 недели (пациенты с массой тела ≥ 30 кг), или 162 мг п/к каждые 3 недели (пациенты с массой тела менее 30 кг).
Таблица 8. Прогнозируемое среднее значение ± стандартное отклонение параметров РК в равновесном состоянии после в/в или п/к дозирования при пЮИА
| в/в | п/к | |||
| Актемра® Параметр РК | 8 мг/кг Q4W≥ 30кг | 10 мг/кг Q4W менее 30 кг | 162 мг Q2W≥ 30кг | 162 мг Q3W менее 30 кг |
| Cmax (мкг/мл) | 183 ± 42,3 | 168 ± 24,8 | 29,4 ± 13,5 | 75,5 ± 24,1 |
| Cmin (мкг/мл) | 6,55 ± 7,93 | 1,47 ± 2,44 | 11,8 ± 7,08 | 18,4 ± 12,9 |
| Cavg (мкг/мл) | 42,2 ± 13,4 | 31,6 ± 7,84 | 21,7 ± 10,4 | 45,5 ±19,8 |
| Cmax при кумуляции | 1,04 | 1,01 | 1,72 | 1,32 |
| Cmin при кумуляции | 2,22 | 1,43 | 3,58 | 2,08 |
| Cavg или AUCτ * | 1,16 | 1,05 | 2,04 | 1,46 |
* τ = 4 недели для в/в схем лечения, 2 недели или 3 недели для двух п/к схем лечения соответственно
После в/в дозирования приблизительно 90 % равновесного состояния достигалось к неделе 12 для дозы 10 мг/кг (BW < 30 кг) и к неделе 16 для дозы 8 мг/кг (BW ≥ 30 кг). После п/к дозирования приблизительно 90 % равновесного состояния достигалось к неделе 12 для обеих схем лечения с дозой 162 мг п/к Q2W и Q3W.
Распределение
У пациентов с РА центральный объем распределения составлял 3,72 л, а периферический объем распределения — 3,35 л, что приводило к объему распределения в равновесном состоянии — 7,07 л.
Выведение
После внутривенного введения препарата Актемра® претерпевает двухфазное выведение из системного кровотока. Общий клиренс препарата Актемра® зависит от концентрации и представляет собой сумму линейного и нелинейного клиренса. В популяционном фармакокинетическом анализе линейный клиренс оценивался как параметр и составлял 12,5 мл/ч. Дозозависимый нелинейный клиренс имеет наибольшее значение при низких концентрациях препарата Актемра®. При более высоких концентрациях тоцилизумаба преобладает линейный клиренс в связи с насыщением пути нелинейного клиренса.
Т1/2 препарата Актемра® зависим от концентрации. После введения препарата в дозе 8 мг/кг каждые 4 недели эффективный T1/2 уменьшался по мере снижения концентраций в промежутке между введениями препарата в состоянии равновесия от 14 до 6 дней.
Линейность
С течением времени фармакокинетические параметры препарата Актемра® не изменялись. Более чем пропорциональное дозе увеличение значений AUC и Cmin наблюдалось при применении доз 4 и 8 мг/кг каждые 4 недели. Значение Cmax повышалось прямо пропорционально увеличению дозы. В равновесном состоянии расчетные AUC и Cmin были в 3,2 и 30 раз больше при дозе 8 мг/кг по сравнению с дозой 4 мг/кг соответственно.
Подкожное введение
Фармакокинетику препарата Актемра® оценивали с использование популяционного фармакокинетического анализа базы данных 3552 пациентов с РА, получавших препарат Актемра® в дозе 162 мг подкожно один раз в неделю, в дозе 162 мг подкожно один раз в две недели и в дозах 4 или 8 мг/кг каждые 4 недели на протяжении 24 недель.
С течением времени фармакокинетические параметры препарата Актемра® не изменялись. При применении препарата в дозе 162 мг один раз в неделю расчетная средняя (± SD) AUC1 неделя в равновесном состоянии, Cmin и Cmax составляла 7970 ± 3432 мкг∙ч/мл, 43,0 ± 19,8 мкг/мл и 49,8 ± 21,0 мкг/мл, соответственно. Коэффициент кумуляции для AUC, Cmin и Cmax был 6,32, 6,30, и 5,27, соответственно.
Равновесное состояние для AUC, Cmin и Cmax было достигнуто после 12 недель.
При применении препарата в дозе 162 мг один раз в две недели расчетная средняя (± SD) AUC2 недели в равновесном состоянии, Cmin и Cmax препарата Актемра® составляла 3430 ± 2660 мкг∙ч/мл, 5,7 ± 6,8 мкг/мл и 13,2 ± 8,8 мкг/мл, соответственно. Коэффициент кумуляции для AUC, Cmin и Cmax был 2,67, 5,6 и 2,12, соответственно. Равновесное состояние для AUC, Cmin было достигнуто после 12 недель, а для Cmax — после 10 недель.
Всасывание
После подкожного введения препарата пациентам с РА время до максимальной концентрации тоцилизумаба в сыворотке Тmax составило 2,8 дня. Биодоступность лекарственной формы для подкожных инъекций составляла 79 %.
После п/к дозирования у пациентов с пЮИА период полуабсорбции составлял примерно 2 дня, а биодоступность для п/к лекарственной формы у пациентов с пЮИА составляла 96 %.
Распределение
У пациентов детского возраста с пЮИА центральный объем распределения составлял 1,97 л, периферический объем распределения составлял 2,03 л, что приводит к объему распределения в равновесном состоянии, равному 4,0 л.
Выведение
При подкожном введении пациентам с RA в равновесном состоянии эффективный период t1/2 равен не более чем 13 дням для дозы 162 мг каждую неделю и 5 дням для дозы 162 мг раз в две недели. Популяционный фармакокинетический анализ для пациентов с пЮИА показал наличие влияния объемов тела на линейный клиренс, поэтому следует рассматривать дозирование на основании массы тела (см. таблицу 8).
После подкожного введения эффективный период t1/2препарата Актемра® у пациентов с пЮИА составляет до 10 дней при массе тела < 30 кг (162 мг п/к Q3W) и до 7 дней при массе тела ≥ 30 кг (162 мг п/к Q2W) в течение интервала дозирования в равновесном состоянии. После внутривенного введения тоцилизумаб претерпевает двухфазное выведение из кровотока. Общий клиренс тоцилизумаба зависел от концентрации и является суммой линейного и нелинейного клиренса. Линейный клиренс оценивался как параметр популяционного фармакокинетического анализа и составлял 6,25 мл/ч. Нелинейный клиренс, зависимый от концентрации, играет основную роль при низких концентрациях тоцилизумаба. Как только путь нелинейного клиренса насыщается, при больших концентрациях тоцилизумаба клиренс преимущественно определяется линейным клиренсом.
ГКА
Подкожное введение
Фармакокинетика лекарственного средства Актемра у пациентов с ГКА была определена с использованием популяционной фармакокинетической модели из анализа набора данных, включающих в себя 149 пациентов с ГКА, получавших лечение дозой в 162 мг подкожно раз в неделю или 162 мг подкожно раз в две недели. Разработанная модель имела такую же структуру, как и популяционная фармакокинетическая модель, разработанная ранее на основании данных о пациентах с РА (см. таблицу 8).
Таблица 9. Прогнозируемое среднее ± SD по фармакокинетическим параметрам в равновесном состоянии после введения подкожной дозы при ГКА
| Подкожно | ||
| Фармакокинетический параметр тоцилизумаба | 162 мг раз в две недели | 162 мг раз в неделю |
| Cmax (мкг/мл) | 19,3 ± 12,8 | 73 ± 30,4 |
| Cmin (мкг/мл) | 11,1 ± 10,3 | 68,1 ± 29,5 |
| Cavg (мкг/мл) | 16,2 ± 11,8 | 71,3 ± 30,1 |
| Аккумулирование, Cmax | 2,18 | 8,88 |
| Аккумулирование, Cmin | 5,61 | 9,59 |
| Аккумулирование, Cavg или AUCτ | 2,81 | 10,91 |
Профиль равновесного состояния после введения дозы препарата Актемра® раз в неделю был почти плоским с очень малыми колебаниями от минимальных к максимальным значениям при наличии значительных колебаний для дозы препарата Актемра®, вводимой раз в две недели. Приблизительно 90 % показателя в равновесном состоянии (AUCτ) было достигнуто к неделе 14 в группе получения препарата раз в две недели и к неделе 17 в группе получения препарата раз в неделю.
На основании текущей характеристики фармакокинетики лекарственного средства препарата Актемра® минимальная концентрация в равновесном состоянии на 50 % выше в данной группе пациентов в сравнении со средними концентрациями в обширном наборе данных о пациентах с РА. Такие различия появляются по неизвестным причинам. Фармакокинетические различия не сопровождаются выраженными различиями в фармакодинамических параметрах, и потому клиническая значимость неизвестна.
Среди пациентов с ГКА большее воздействие наблюдалось у субъектов с меньшей массой тела. При режиме дозирования 162 мг раз в неделю показатель Cavg в равновесном состоянии был на 51 % больше у пациентов с массой тела менее чем 60 кг, в сравнении с пациентами с весом от 60 до 100 кг. При режиме дозирования 162 мг раз в две недели показатель Cavg был на 129 % больше у пациентов с массой тела менее чем 60 кг, в сравнении с пациентами с весом от 60 до 100 кг. Данные для пациентов с весом более 100 кг ограничены (n = 7).
Всасывание
После подкожной инъекции пациентам с ГКА показатель всасывания t1/2 составлял примерно 4 дня. Биодоступность подкожной лекарственной формы была 0,8. Средние значения Tmax — 3 дня после получения дозы препарата Актемра® раз в неделю и 4,5 дня — после получения тоцилизумаба раз в две недели.
Распределение
У пациентов с ГКА центральный объем распределения составлял 4,09 л, периферический объем распределения — 3,37 л, что приводит к объему распределения в равновесном состоянии, равному 7,46 л.
Выведение
Общий клиренс лекарственного средства Актемра® зависел от концентрации и является суммой линейного клиренса и нелинейного клиренса. Линейный клиренс рассчитывался как параметр популяционного фармакокинетического анализа и равнялся у пациентов с ГКА 6,7 мл/ч.
У пациентов с ГКА в равновесном состоянии эффективный период полувыведения (t1/2) лекарственного средства Актемра® различался от 18,3 до 18,9 дня для режимов с дозой 162 мг в неделю и от 4,2 до 7,9 для режимов с дозой 162 мг раз в две недели. При высоких концентрациях в сыворотке крови, когда в общем клиренсе препарата Актемра® преобладает линейный клиренс, из примерной оценки популяционного параметра был выведен эффективный t1/2, равный приблизительно 32 дням.
Особые группы пациентов
Почечная недостаточность
Формального исследования влияния почечной недостаточности на фармакокинетику препарата Актемра® не проводилось. В популяционном фармакокинетическом анализе у большинства пациентов РА и ГКА имела место нормальная функция почек или почечная недостаточность легкой степени тяжести. Почечная недостаточность легкой степени тяжести (клиренс креатинина по формуле Кокрофта-Голта) не влияла на фармакокинетику препарата Актемра®.
Приблизительно одна треть пациентов в исследовании ГКА на базовом уровне страдала от почечной недостаточности умеренной степени (примерный клиренс креатинина — 30—59 мл/мин). У данных пациентов не наблюдалось влияния на воздействие препарата Актемра®.
Коррекция дозы не требуется для пациентов с почечной недостаточностью легкой или умеренной степени.
Печеночная недостаточность
Формального исследования влияния печеночной недостаточности на фармакокинетику препарата Актемра® не проводилось.
Возраст, пол и расовая принадлежность
Результаты популяционного фармакокинетического анализа для пациентов с пЮИА подтвердили, что объемы тела являются единственной независимой переменной, которая оказывает ощутимое влияние на фармакокинетику лекарственного средства Актемра®, включая выведение и всасывание, таким образом, следует рассматривать дозирование на основании массы тела (см. таблицу 8).
Доклинические данные по безопасности
Доклинические данные, полученные из стандартных исследований по изучению фармакологической безопасности, токсичности многократных доз, генотоксичности и токсичности в отношении репродуктивности и развития не показали особой опасности для человека.
Исследований по изучению канцерогенности тоцилизумаба не проводилось, поскольку признано, что моноклональные антитела IgG1 не обладают истинной способностью вызывать рак. Имеющиеся доклинические данные продемонстрировали влияние ИЛ-6 на прогрессирование злокачественных новообразований и устойчивость к апоптозу при различных формах рака. Эти данные свидетельствую о том, что лечение препаратом Актемра® не приводит к существенному риску развития и прогрессирования рака. Кроме того, при проведении 6-месячных исследований по изучению хронической токсичности на яванских макаках и мышах с недостаточностью ИЛ-6 пролиферативных поражений не наблюдалось.
Имеющиеся доклинические данные не предполагают влияния тоцилизумаба на фертильность. В исследованиях по изучению хронической токсичности у яванских макак и у самок или самцов мышей с недостаточностью ИЛ-6 влияния тоцилизумаба на эндокринную или репродуктивную систему не наблюдалось. При введении препарата Актемра® яванским макакам во время ранней стадии беременности прямого или непрямого неблагоприятного влияния беременность или развитие эмбриона либо плода не наблюдалось. Однако наблюдалось незначительное увеличение случаев спонтанного выкидыша / внутриутробной гибели плода при высоком уровне системной концентрации (более чем в 100 раз превышающего таковую для человека) в группе, получавшей препарат в высоких дозах, равных 50 мг/кг/сут, в сравнении с группой плацебо или группой, получавшей препарат в низких дозах. Несмотря на то что ИЛ-6, по-видимому, не является цитокином, играющим решающую роль в развитии плода или иммунологической регуляции системы мать-плод, взаимосвязь этих явлений с введением препарата Актемра® не может быть исключена.
Лечение мышиным аналогом тоцилизумаба не оказывало токсичного действия на ювенильных мышей. В частности, не было нарушений развития скелета, иммунной системы и полового созревания. Доклинический профиль безопасности применения препарата Актемра® у яванских макак свидетельствует об отсутствии различий между внутривенным и подкожным способами введения.
Несовместимость
Ввиду отсутствия исследований по изучению совместимости препаратов запрещается смешивать данное лекарственное средство с другими препаратами.
Актемра Показания к применению
Препарат Актемра® в комбинации с метотрексатом (МТ) показан для:
лечения тяжелого, активного и прогрессирующего ревматоидного артрита (РА) у взрослых пациентов, не получавших ранее метотрексат;
лечения РА средней или высокой степени активности у взрослых пациентов с неадекватным ответом на предшествующую терапию одним или более базисным противовоспалительным препаратом (БПВП) или антагонистами фактора некроза опухолей (ФНО), либо при непереносимости таковых. В случае непереносимости МТ или нецелесообразности продолжения лечения МТ можно использовать препарат Актемра® в виде монотерапии.
Согласно рентгенологическим данным было показано, что в комбинации с МТ препарат Актемра® тормозит прогрессирование деструкции суставов и улучшает их функцию.
Препарат Актемра® в комбинации с метотрексатом (МТ) показан для лечения ювенильного идиопатического полиартрита (пЮИА) (с положительным или отрицательным ревматоидным фактором и распространенным олигоартритом) у пациентов в возрасте 2 лет и старше, с неадекватным ответом на предыдущую терапию МТ.
Актемра® может использоваться в качестве монотерапии в случае непереносимости МТ либо нецелесообразности продолжения лечения МТ.
Препарат Актемра® показан для лечения гигантоклеточного артериита (ГКА) у взрослых пациентов.
Способ применения Актемра и дозировка
Тоцилизумаб в лекарственной форме для подкожного введения вводится при помощи одноразового предварительно заполненного шприца с защитным колпачком для иглы (PFS+NSD). Лечение должен начинать медицинский работник, имеющий опыт в диагностике и лечении РА, пЮИА и/или ГКА. Первую инъекцию необходимо делать под контролем квалифицированного медицинского работника. Пациент может самостоятельно вводить препарат Актемра®, только если врач устанавливает, что это допустимо, и пациент соглашается на последующее медицинское наблюдение по мере необходимости, а также проходит инструктаж по правильной технике введения.
Пациенты, переведенные с внутривенной (в/в) терапии тоцилизумабом на подкожное (п/к) введение должны получать первую п/к дозу в момент следующей в/в дозы по схеме лечения под контролем квалифицированного медицинского работника.
Пациенты, получающие лечение препаратом Актемра®, должны быть снабжены памяткой для пациента.
Возможность самостоятельного подкожного введения пациентом или родителем/опекуном на дому должна быть проанализирована, и пациенты или родитель/опекун должны быть уведомлены о необходимости сообщать медицинскому работнику о появлении симптомов аллергической реакции до введения следующей дозы. Пациенты должны немедленно обратиться за медицинской помощью при развитии симптомов серьезной аллергической реакции (смотрите раздел «Особые указания и меры предосторожности при применении»).
Режим дозирования
Препарат Актемра® в лекарственной форме «раствор для подкожного введения» не предназначендля внутривенного введения.
РА
Рекомендуемый режим дозирования — 162 мг подкожно один раз в неделю.
Имеющиеся данные, относительно перевода пациентов с лекарственной формы для внутривенных инфузий препарата Актемра® на лекарственную форму для подкожных инъекций в виде готовых к использованию фиксированных доз, ограничены. Между введением доз следует соблюдать интервал — 1 неделю.
При переходе пациента с внутривенного на подкожный способ введения препарата Актемра® первую подкожную инъекцию следует произвести вместо следующей плановой внутривенной инфузий под руководством квалифицированного медицинского работника.
ГКА
Рекомендуемая доза составляет 162 мг один раз в неделю подкожно в комбинации с курсом глюкокортикоидов с постепенным снижением дозы. Лекарственное средство Актемра® может использоваться отдельно после отмены глюкокортикоидов.
Монотерапию препаратом Актемра® не следует использовать для лечения острых рецидивов (см. раздел «Особые указания и меры предосторожности при применении»).
Основываясь на хроническом характере ГКА, лечение по истечении 52 недель необходимо проводить с учетом активности заболевания, указаний врача и выбора пациента.
РА и ГКА
Коррекция дозы при отклонении лабораторных показателей от нормы (смотрите раздел «Особые указания и меры предосторожности при применении»).
Повышение активности печеночных ферментов
| Значение показателя | Действие |
| Превышение верхней границы нормы (ВГН) в 1—3 раза | При необходимости провести коррекцию дозы одновременно назначаемого БПВП (РА) или иммуномодулирующего агента (ГКА), если применимо.При устойчивом повышении в этом диапазоне — снизить частоту инъекций до одного раза в две недели или прервать лечение препаратом Актемра® до нормализации показателей аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT). Исходя из клинической ситуации — возобновить введение препарата еженедельно или один раз в две недели. |
| Превышение ВГН в 3—5 раз | Прервать лечение препаратом Актемра® до снижения показателя до уровня, менее чем в 3 раза превышающего ВГН; далее следовать рекомендациям для превышения ВГН в 1—3 раза, как указано выше. Прекратить лечение препаратом Актемра® при устойчивом повышении показателя, превышающем ВГН более чем в 3 раза (подтвержденное при повторном исследовании, смотрите раздел «Особые указания и меры предосторожности при применении»). |
| Превышение ВГН более чем в 5 раз | Прекратить лечение препаратом Актемра®. |
Низкое абсолютное число нейтрофилов (АЧН)
Не рекомендуется начинать лечение у пациентов, ранее не получавших препарат Актемра® с абсолютным числом нейтрофилов (АЧН) ниже 2 х 109/л.
| Значение показателя (число клеток 109/л) | Действие |
| АЧН выше 1 | Дозу не изменять. |
| АЧН 0,5—1 | Прервать лечение препаратом Актемра®.При увеличении показателя АЧН выше 1 109/л — возобновить лечение препаратом Актемра® один раз в две недели и увеличить частоту инъекций до еженедельного введения в соответствии с клинической необходимостью. |
| АЧН ниже 0,5 | Прекратить введение препарата Актемра®. |
Низкое число тромбоцитов
| Значение показателя (число клеток 103/мкл) | Действие |
| 50—100 | Прервать лечение препаратом Актемра®.При увеличении числа тромбоцитов выше 100 103/мкл — возобновить введение препарата один раз в две недели и увеличить частоту инъекций до еженедельного введения в соответствии с клинической необходимостью. |
| менее 50 | Прекратить введение препарата Актемра®. |
Пропущенная доза
Если пациент пропускает подкожную инъекцию препарата Актемра® при частоте введения препарата один раз в неделю в течение 7 дней от запланированной даты приема, его следует проинформировать о необходимости принять пропущенную дозу в следующую запланированную дату приема. При пропуске подкожной инъекции препарата Актемра® при частоте введения препарата один раз в две недели в течение 7 дней от запланированной даты приема, пациента необходимо проинформировать о необходимости принять пропущенную дозу немедленно, а следующую дозу — в следующую запланированную дату приема.
Особые группы
Пациенты пожилого возраста
Коррекции дозы у пациентов в возрасте 65 лет и старше не требуется.
Почечная недостаточность
Коррекции дозы у пациентов с почечной недостаточностью легкой или умеренной степени тяжести не требуется. Применение препарата Актемра® у пациентов с почечной недостаточностью тяжелой степени не изучалось (смотрите раздел «Фармакокинетические свойства»). У таких пациентов следует тщательно наблюдать за функцией почек.
Печеночная недостаточность
Применение препарата Актемра® у пациентов с печеночной недостаточностью не изучалось. Поэтому невозможно дать рекомендаций по дозированию препарата.
Пациенты с пЮИА
Изменение дозы должно основываться только на постоянном изменении массы тела пациента с течением времени.
Рекомендуемые дозы для пациентов старше 2 лет составляют 162 мг подкожно один раз в 2 недели для пациентов с массой тела 30 кг или более, либо 162 мг подкожно один раз в 3 недели для пациентов с массой тела менее 30 кг.
При необходимости доза одновременно получаемого МТ и/или других препаратов должна быть изменена, либо их дозирование следует прекратить, и прервать прием тоцилизумаба до оценки клинической ситуации. Так как существует много сопутствующих состояний, которые могут повлиять на лабораторные показатели при пЮИА, решение об отмене тоцилизумаба по причине аномальных лабораторных данных должно основываться на медицинской оценке каждого отдельного пациента.
Повышение активности печеночных ферментов
| Лабораторный показатель | Действие |
| Превышение верхней границы нормы (ВГН) в 1—3 раза | При необходимости провести коррекцию дозы одновременно назначаемого МТ.При устойчивом повышении в этом диапазоне прервать лечение препаратом Актемра® до нормализации показателей АЛТ/АСТ. |
| Превышение ВГН в 3—5 раз | При необходимости провести коррекцию дозы одновременно назначаемого МТ.Прервать лечение препаратом Актемра® до снижения показателя до уровня, менее чем в 3 раза превышающего ВГН; далее следовать рекомендациям для превышения ВГН в 1—3 раза, как указано выше. |
| Превышение ВГН более чем в 5 раз | Прекратить лечение препаратом Актемра®.Решение о прекращении лечения лекарственным средством Актемра® при пЮИА по причине аномальных лабораторных показателей должно быть основано на медицинской оценке каждого отдельного пациента. |
Низкое абсолютное число нейтрофилов (АЧН)
| Значение показателя (число клеток 109/л) | Действие |
| АЧН выше 1 | Дозу не изменять. |
| АЧН 0,5—1 | Прервать лечение препаратом Актемра®.При увеличении показателя АЧН выше 1 109/л — возобновить лечение препаратом Актемра®. |
| АЧН ниже 0,5 | Прекратить лечение препаратом Актемра®.Решение о прекращении лечения лекарственным средством Актемра® при пЮИА по причине аномальных лабораторных показателей должно быть основано на медицинской оценке каждого отдельного пациента. |
Низкое число тромбоцитов
| Значение показателя (число клеток 103/мкл) | Действие |
| 50—100 | При необходимости провести коррекцию дозы одновременно назначаемого МТ.Прервать лечение препаратом Актемра®.При увеличении числа тромбоцитов выше 100 103/мкл — возобновить введение препарата Актемра®. |
| менее 50 | Прекратить лечение препаратом Актемра®.Решение о прекращении лечения лекарственным средством Актемра® при пЮИА по причине аномальных лабораторных показателей должно быть основано на медицинской оценке каждого отдельного пациента. |
Сокращение частоты дозирования вследствие аномальных лабораторных параметров не исследовалось на пациентах с пЮИА.
Безопасность и эффективность лекарственного средства Актемра® в лекарственной форме для подкожного введения у детей с другими состояниями, помимо пЮИА, не установлены.
Имеющиеся данные по внутривенной лекарственной форме предполагают, что клиническое улучшение наблюдается в течение 12 недель с начала лечения препаратом Актемра®. Длительная терапия должна быть тщательно пересмотрена для пациента, не демонстрирующего улучшений в течение указанных сроков.
Пропуск дозы
Если пациент с пЮИА пропускает подкожную инъекцию лекарственного средства Актемра® в течение 7 дней запланированного дозирования, он/она должен (должна) получить пропущенную дозу сразу же, как только о ней вспомнил(а), а следующую инъекцию необходимо сделать в обычное время по схеме. Если пациент пропускает подкожную инъекцию препарата Актемра® более чем на 7 дней запланированного дозирования, либо не уверен во времени, когда следует вводить Актемра®, ему/ей следует обратиться к врачу или фармацевту.
Способ применения
Препарат Актемра® предназначен для подкожного введения.
После надлежащего обучения технике инъекционного введения лекарственного средства пациенты могут делать себе инъекции препарата Актемра® самостоятельно, если врач посчитает это целесообразным. Все содержимое (0,9 мл) шприц-тюбика должно быть введено подкожно. Рекомендуемые места для введения препарата (живот, бедро и плечо) следует чередовать. Противопоказано делать инъекции в места родинок, шрамов или в участки, где кожа чувствительная, ушибленная, красная, плотная или поврежденная.
Не следует встряхивать шприц-тюбик.
Подробные инструкции по введению препарата Актемра® в шприц-тюбиках приведены в разделе «Особые меры предосторожности при обращении с препаратом и его утилизации».
Изображение шприц-тюбика с описанием
До использования:
После использования:
Этап 1. Осмотр шприц-тюбика
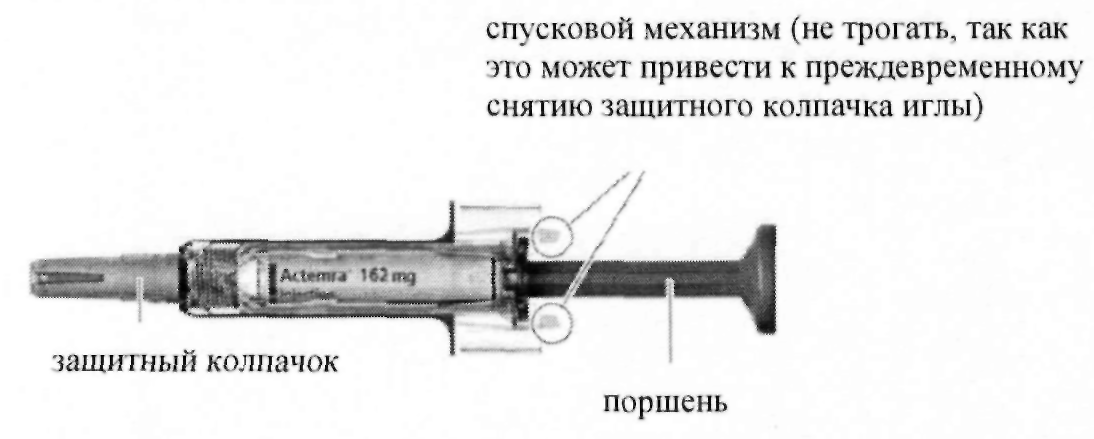
Извлеките упаковку со шприц-тюбиком из холодильника и откройте ее. Не трогайте спусковой механизм — это может привести к неисправности шприц-тюбика.
Извлеките шприц-тюбик с лекарственным препаратом из упаковки и осмотрите его, а также лекарственный препарат, находящийся в нем. Важно удостовериться, что шприц-тюбик и препарат безопасны для применения.
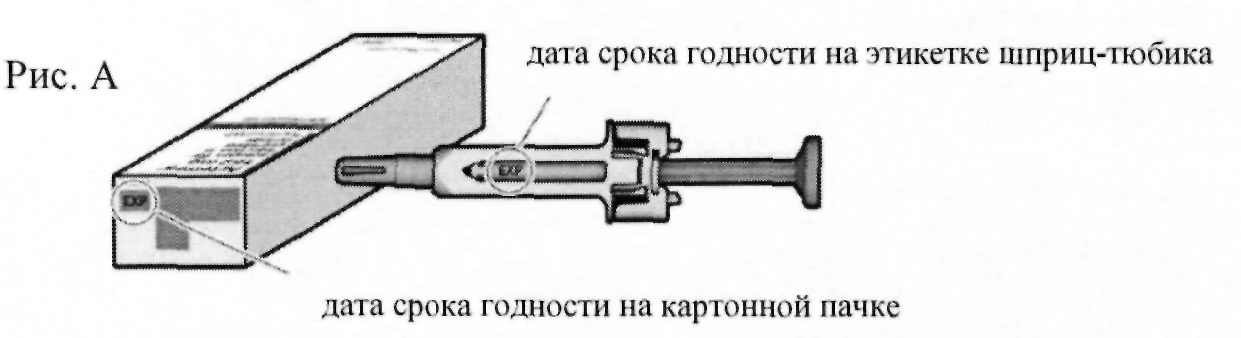
Проверьте дату истечения срока годности на картонной пачке и этикетке шприц-тюбика (см. рис. А), чтобы удостовериться в том, что срок годности не истек. Запрещается применение шприц-тюбика, если срок годности истек. Важно удостовериться, что шприц-тюбик и препарат безопасны для применения.
Шприц-тюбик нельзя использовать и следует утилизировать в следующих случаях:
помутнение лекарственного препарата;
наличие в лекарственном препарате видимых частиц;
изменение цвета на любой, кроме диапазона от бесцветного до слегка желтоватого цвета;
повреждение любых частей шприц-тюбика.
Этап 2. Доведение шприц-тюбика до комнатной температуры
Не снимайте колпачок шприц-тюбика до этапа 5. Преждевременное снятие защитного колпачка может привести к высыханию препарата и засорению иглы.
Поместите шприц-тюбик на чистую плоскую поверхность и оставьте его при комнатной температуре в течение приблизительно 25—30 минут. В случае если температура шприц-тюбика не доведена до комнатной, то это может привести к неудобствам во время инъекции и тугости при нажатии на поршень.
Не следует согревать шприц-тюбик каким-либо другим способом.
Этап 3. Обработка рук
Вымойте руки водой с мылом.
Этап 4. Выбор и подготовка места инъекции
Инъекции рекомендуется производить в переднюю и среднюю поверхность середины бедра, и в нижнюю часть живота (ниже пупка), за исключением области диаметром пять сантиметров непосредственно вокруг пупка (см. рис. В).
Если инъекция производится лицом, ухаживающим за пациентом, также можно произвести инъекции в наружную поверхность плеча (см. рис. В).
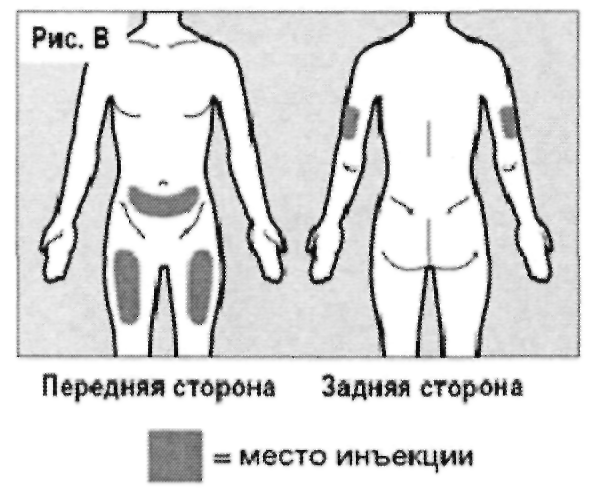
Необходимо каждый раз менять место введения препарата (при проведении инъекции рекомендуется отступать не менее чем на три сантиметра от области предыдущей инъекции).
Следует избегать участков, которые могут подвергаться механическому воздействию (ремнем или поясом одежды). Не следует вводить препарат в родимые пятна, ткани рубцов, гематомы или участки с чувствительной кожей, покраснением, в места с уплотнением или в поврежденный участок кожи.
Тщательно обработайте намеченную область спиртовой салфеткой (см. рис. С) во избежание риска инфекции.
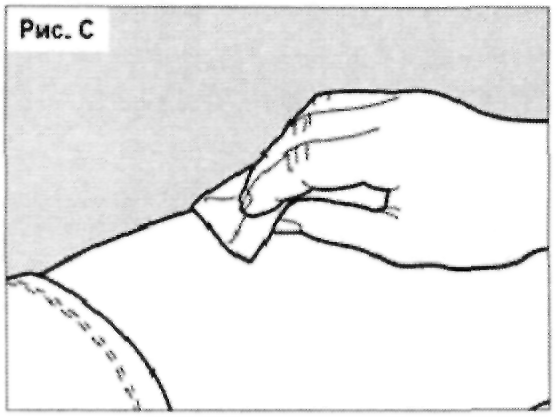
Подождите примерно 10 секунд, пока обработанный участок кожи подсохнет.
Не касайтесь данной области до выполнения инъекции. Запрещается обмахивать или обдувать обработанный участок кожи.
Этап 5. Подготовка шприц-тюбика
Не рекомендуется держать шприц за поршень при снятии защитного колпачка.
Крепко удерживая шприц-тюбик за защитный корпус одной рукой, осторожно снимите защитный колпачок с иглы другой рукой (см. рис. D). Если вы не можете снять колпачок с иглы, обратитесь за помощью к лицу, осуществляющему уход или к медицинскому работнику.
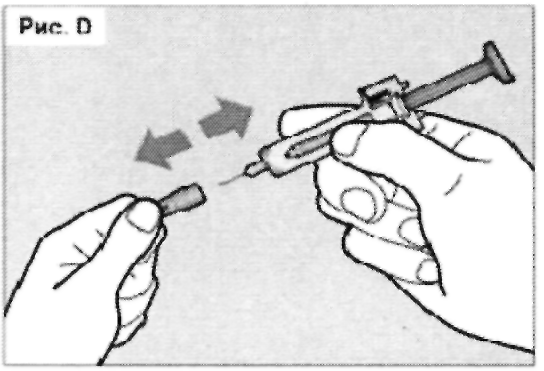
Не прикасайтесь к игле и не позволяйте ей соприкасаться с любой поверхностью.
Вы можете увидеть каплю жидкости на конце иглы. Это приемлемо.
Уберите колпачок иглы в стойкий к прокалыванию контейнер или контейнер для острых медицинских отходов.
Внимание! После удаления колпачка следует немедленно использовать шприц-тюбик.
В случае если шприц-тюбик не был использован в течение 5 минут после снятия колпачка, он подлежит утилизации в стойкий к прокалыванию контейнер или контейнер для острых медицинских отходов, и вместо него следует использовать новый шприц-тюбик. Таким образом, если шприц-тюбик не был использован в данный период времени, выполнение инъекции станет более трудным по причине того, что препарат высыхает и блокирует иглу.
Не надевайте защитный колпачок после снятия.
Этап 6. Введение препарата
Удобно удерживайте шприц-тюбик одной рукой.
Свободной рукой соберите кожу в складку в месте предполагаемой инъекции, чтобы удостовериться, что игла вводится под кожу надлежащим образом. Собрать кожу в складку в месте предполагаемой инъекции является весьма важным для гарантии того, что игла была введена под кожу (в жировую ткань), но не глубже (в мышцу). Введение иглы в мышцу может вызвать неприятные ощущения в месте введения.
При введении иглы в кожную складку, не удерживайте и не нажимайте на поршень.
Полностью введите иглу в кожную складку под углом в диапазоне от 45° до 90° быстрым и точным движением (см. рис. Е).
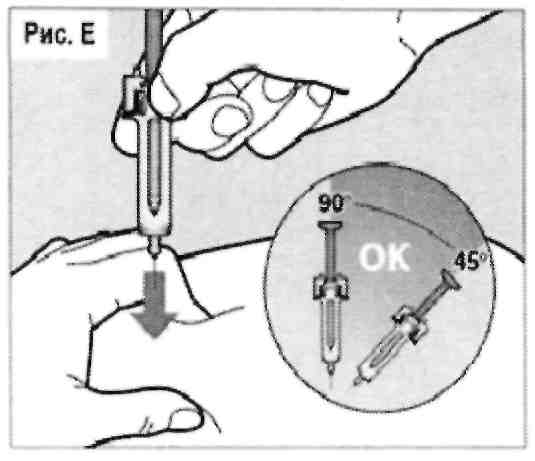
Весьма важно выбрать правильный угол, чтобы удостовериться в том, что препарат был введен под кожу (в жировые ткани). В противном случае инъекция может быть весьма болезненной, а также препарат может не подействовать.
Удерживая шприц-тюбик в данном положении, отпустите складку кожи.
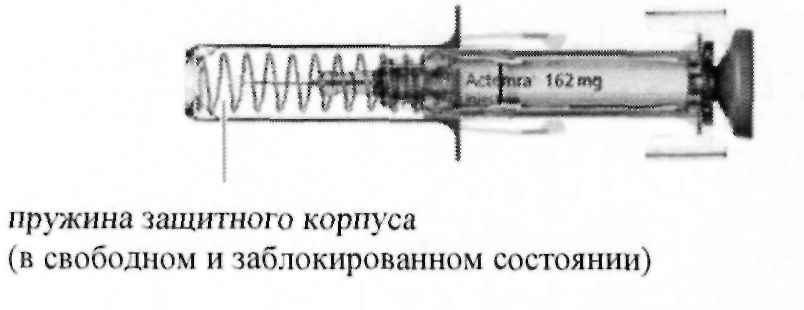
Плавно нажимая на поршень, медленно введите весь лекарственный препарат (см. рис. F). Чтобы удостоверится в том, что доза была введена в полном объеме, а также что спусковой механизм находится в полностью выдвинутом положении, необходимо нажать на поршень до самого конца. Если поршень введен не до конца, то защитный корпус не выдвинется для закрытия иглы при ослаблении поршня. В случае если игла не закрыта, то необходимо с осторожностью убрать шприц-тюбик в стойкий к прокалыванию контейнер во избежание нанесения повреждений иглой.
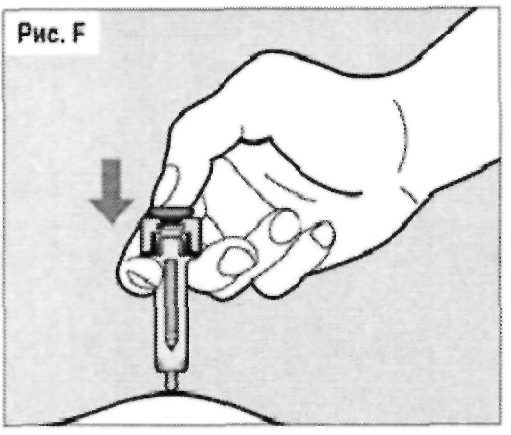
Перед извлечением иглы из кожи, при полном введении поршня, не прекращайте давить на поршень шприц-тюбика, пока не будет полностью введен весь препарат.
Не прекращайте давить на поршень шприц-тюбика под тем же углом, под которым он был введен, пока полностью не извлечете иглу из кожи (см. рис. G).
Если после введения иглы вы не сможете сдвинуть поршень вниз, то необходимо утилизировать шприц-тюбик в стойкий к прокалыванию контейнер и использовать новый шприц-тюбик (начиная с этапа 2). Если трудности с подвижностью поршня сохраняются, то проконсультируйтесь с медицинским работником.
При полном извлечении иглы из кожи вы можете ослабить поршень, позволяя защитному корпусу закрыть иглу (см. рис. Н).
•
При наличии крови в месте инъекции прижмите стерильный ватный тампон или марлевую салфетку к месту введения лекарственного препарата примерно на 10 секунд.
Не растирайте место инъекции.
Этап 7. Утилизация шприц-тюбика
Надевать защитный колпачок на шприц-тюбик не требуется.
Использованный шприц-тюбик необходимо поместить в стойкий к прокалыванию контейнер или контейнер для острых медицинских отходов. Для получения информации о том, где приобрести «контейнер для острых медицинских отходов» и какие прочие типы стойких к прокалыванию контейнеров вы можете использовать для безопасной утилизации использованных шприц-тюбиков, обратитесь к медицинскому работнику или фармацевту (см. рис. I).
Проконсультируйтесь с медицинским работником для получения инструкций по надлежащей утилизации использованных шприц-тюбиков в соответствие с местным требованиями.
Не утилизируйте использованные шприц-тюбики или стойкий к прокалыванию контейнер вместе с домашним мусором, а также не подвергайте их переработке.
Утилизируйте полный контейнер в соответствие с инструкциями медицинского работника или фармацевта.
Необходимо держать стойкий к прокалыванию контейнер в недоступном для детей месте.
Побочные действия
Резюме профиля безопасности
Профиль безопасности базируется на 4510 пациентов, подвергавшихся воздействию лекарственного средства Актемра® в рамках клинических испытаний; большинство данных пациентов участвовали в исследованиях РА (n = 4009), при этом остальной опыт был получен при исследовании ГКА (n = 149), пЮИА (n = 240) и сЮИА (n = 112). Профиль безопасности лекарственного средства Актемра® по данным показаниям остается схожим и не дифференцированным.
Наиболее часто сообщаемыми нежелательными реакциями (HP) были инфекции верхних дыхательных путей, назофарингит, головная боль, гипертензия и повышенная активность АЛТ. Самыми серьезными HP были серьезные инфекции, осложнения дивертикулита и реакции гиперчувствительности.
Табличное резюме нежелательных реакций
HP, перечисленные в таблице 1, представлены по классам систем органов и категориям частоты, определенных следующим образом: очень часто (≥ 1/10), часто (от ≥ 1/100, но < 1/10), нечасто (от ≥ 1/1000, но < 1/100), редко (от ≥ 1/10 000, но < 1/1000), очень редко (< 1/10 000). В пределах каждой категории нежелательные реакции представлены в порядке начиная с серьезных.
Таблица 1. Обобщенные данные о нежелательных реакциях, которые встречались у пациентов, получавших препарат Актемра®.
| Системно-органные классы | Очень часто | Часто | Нечасто |
| Нарушения со стороны крови и лимфатической системы | Лейкопения, нейтропения | ||
| Эндокринные нарушения | Гипотиреоз | ||
| Нарушения со стороны органа зрения | Конъюнктивит | ||
| Желудочно-кишечные нарушения | Боли в животе, изъязвления ротовой полости, гастрит | Стоматит, язва желудка | |
| Общие нарушения и реакции в месте введения | Реакции в месте инъекции | Периферический отек, реакции гиперчувствительности | |
| Инфекции и инвазии | Инфекции верхних дыхательных путей | Флегмона, пневмония, оральный простой герпес, опоясывающий герпес | Дивертикулит |
| Лабораторные и инструментальные данные | Повышение активности печеночных трансаминаз, увеличение массы тела, повышение общего билирубина* | ||
| Нарушения метаболизма и питания | Гиперхолестеринемия* | Гипертриглицеридемия | |
| Нарушения со стороны нервной системы | Головная боль, головокружение | ||
| Нарушения со стороны почек и мочевыводящих путей | Почечнокаменная болезнь | ||
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Кашель, одышка | ||
| Нарушения со стороны кожи и подкожных тканей | Сыпь, зуд, крапивница | ||
| Нарушения со стороны сосудов | Гипертензия |
* Включает повышения, полученные при рутинном мониторинге лабораторных показателей (смотрите текст ниже)
РА
Внутривенное введение
Безопасность лекарственного средства Актемра® изучалась в рамках 5двойных слепых контролируемых исследований фазы III, а также в течение периодов их продления.
Вся контрольная популяция включает в себя всех пациентов из двойных слепых фаз каждого базового исследования от момента рандомизации до первого изменения терапевтической схемы, либо до истечения двух лет. Контрольный период в 4 исследованиях составлял 6 месяцев и в одном исследовании — до 2 лет. В двойных слепых контролируемых исследованиях 774 пациента получали Актемра® в дозе 4 мг/кг в комбинации с МТ, 1870 пациентов получали тоцилизумаб в дозе 8 мг/кг в комбинации с МТ / прочими базисными препаратами для лечения ревматоидного артрита (БПВП) и 288 пациентов получали монотерапию тоцилизумабом в дозе 8 мг/кг.
Вся популяция, подвергавшаяся воздействию, включает в себя всех пациентов, получивших, как минимум, одну дозу препарата Актемра® в рамках двойного слепого контрольного периода, либо в течение открытой фазы продления исследований. Из 4009 пациентов в этой популяции 3577 получали лечение в течение не менее 6 месяцев, 3296 — в течение не менее одного года; 2806 пациентов получали лечение не менее 2 лет и 1222 — в течение 3 лет.
Описание отдельных нежелательных реакций
Инфекции
По данным 6-месячных контролируемых исследований частота всех инфекций, о которых сообщалось при введении препарата Актемра® в дозе 8 мг/кг в комбинации с БПВП, составила 127 случаев на 100 пациенто-лет в сравнении с 112 случаями на 100 пациенто-лет в группе, получавшей плацебо в комбинации с БПВП. В популяции долгосрочного применения общая частота инфекций на фоне применения препарата Актемра® составила 108 случаев на 100 пациенто-лет. По данным 6-месячных контролируемых клинических исследований частота серьезных инфекций в группе, принимавшей препарат Актемра® в дозе 8 мг/кг в комбинации с БПВП, составила 5,3 случая на 100 пациенто-лет в сравнении с 3,9 случая на 100 пациенто-лет в группе, получавшей плацебо в комбинации с БПВП. В исследовании монотерапии препаратом в группе, принимавшей препарат Актемра®, частота серьезных инфекций составила 3,6 случая на 100 пациенто-лет по сравнению с 1,5 случая на 100 пациенто-лет в группе, получавшей МТ.
В популяции долгосрочного применения общая частота серьезных инфекций (бактериальных, вирусных и грибковых) составила 4,7 случая на 100 пациенто-лет. Сообщаемые серьезные инфекционные заболевания, в том числе с летальным исходом, включали: активный туберкулез, который мог быть внутрилегочным или внелегочным, инвазивные инфекции легких, включая кандидоз, аспергиллез, кокцидиоидомикоз, пневмоцистную пневмонию Йировеца, флегмону, простой герпес, гастроэнтерит, дивертикулит, сепсис и бактериальный артрит. Сообщалось о случаях возникновения оппортунистических инфекций.
Интерстициальное заболевание легких
Нарушение функции легких может повышать риск развития инфекций. В период постмаркетинговых наблюдений поступали сообщения о развитии интерстициального заболевания легких (включая пневмонит и фиброз легких), в том числе с летальным исходом.
Перфорации ЖКТ
Во время проведения 6-месячных контролируемых клинических исследований в группе пациентов, получавших терапию препаратом Актемра®, общая частота перфораций ЖКТ составила 0,26 случая на 100 пациенто-лет. В популяции длительного применения общая частота перфораций ЖКТ составила 0,28 случая на 100 пациенто-лет. Главным образом, о случаях перфорации ЖКТ сообщалось в виде осложнения дивертикулита, включая разлитой гнойный перитонит, перфорацию нижних отделов ЖКТ, свищ и абсцесс.
Инфузионные реакции
В 6-месячных контролируемых исследованиях сообщалось о нежелательных реакциях, связанных с введением препарата (определенные реакции, возникающие во время введения препарата или в течение 24 часов после инфузии) у 6,9 % пациентов, получавших тоцилизумаб в дозе 8 мг/кг в комбинации с БПВП, и у 5,1 % пациентов, получавших плацебо в комбинации с БПВП. Нежелательными реакциями, которые отмечались во время введения препарата, главным образом, были эпизоды повышения артериального давления; нежелательными реакциями, о которых сообщалось в течение 24 часов после окончания введения препарата, являлись головная боль и реакции со стороны кожных покровов (сыпь, крапивница). Эти реакции не приводили к ограничению терапии.
Частота анафилаксии (в целом встречалась у 6 из 3778 пациентов — 0,2 %) была в несколько раз выше при использовании препарата в дозе 4 мг/кг, чем в дозе 8 мг/кг. В контролируемых и открытых клинических исследованиях клинически значимые реакции гиперчувствительности, обусловленные введением препарата Актемра® и потребовавшие прекращения лечения, отмечены в целом у 13 из 3778 пациентов (0,3 %). В основном данные реакции наблюдались в период между второй и пятой инфузией препарата Актемра® (смотрите раздел «Особые указания и меры предосторожности при применении»). В постмаркетинговом периоде наблюдения сообщали о развитии анафилаксии с летальным исходом на фоне терапии препаратом Актемра® для внутривенных инфузий (смотрите раздел «Особые указания и меры предосторожности при применении»).
Иммуногенность
В 6-месячных контролируемых клинических исследованиях в целом 2876 пациентов было обследовано на антитела к препарату Актемра®. У 46 пациентов (1,6 %) образовались антитела к тоцилизумабу; из них у 6 пациентов были клинически значимые реакции гиперчувствительности, у 5 пациентов это привело к полной отмене лечения. У тридцати пациентов (1,1 %) образовались нейтрализующие антитела.
Отклонения гематологических показателей от нормы
Нейтрофилы
В 6-месячных контролируемых исследованиях снижение числа нейтрофилов ниже 1 109/л происходило у 3,4 % пациентов, которым препарат Актемра® вводили в дозе 8 мг/кг в комбинации с БПВП, по сравнению с менее 0,1 % пациентов, получавших плацебо в комбинации с БПВП. Приблизительно у половины пациентов с АЧН менее 1 109/л такое снижение возникало в течение 8 недель после начала терапии. Снижение числа нейтрофилов ниже 0,5 109/л сообщалось у 0,3 % пациентов, получавших препарат Актемра® в дозе 8 мг/кг в комбинации с БПВП. Сообщалось о случаях инфекций с нейтропенией.
В двойной слепой контролируемый период при долгосрочном применении характер и частота снижения числа нейтрофилов были аналогичны таковым, наблюдавшимся в 6-месячных контролируемых клинических исследованиях.
Тромбоциты
В 6-месячных контролируемых исследованиях снижение числа тромбоцитов ниже 100 103/мкл происходило у 1,7 % пациентов, получавших препарат Актемра® в дозе 8 мг/кг в комбинации с БПВП, по сравнению с менее 1 % пациентов, получавших плацебо в комбинации с БПВП. Данные изменения не сопровождались развитием эпизодов кровотечения.
Во время двойного слепого контролируемого периода и долгосрочного применения характер и частота снижения числа тромбоцитов соответствовали таковым, наблюдавшимся в 6-месячных контролируемых клинических исследованиях.
В период постмаркетинговых наблюдений очень редко поступали сообщения о панцитопении.
Повышение активности печеночных трансаминаз
В ходе проведения 6-месячных клинических исследований транзиторное повышение активности АЛТ/АСТ, более чем в 3 раза превышающее ВГН, наблюдалось у 2,1 % пациентов, получавших препарат Актемра® в дозе 8 мг/кг, по сравнению с 4,9 % пациентов, получавшими МТ, и у 6,5 % пациентов, получавших препарат Актемра® в дозе 8 мг/кг в комбинации с БПВП, по сравнению с 1,5 % пациентов, получавших плацебо в комбинации с БПВП.
Присоединение к монотерапии тоцилизумабом препаратов, обладающих потенциальным гепатотоксическим действием (например, МТ), приводило к увеличению частоты случаев повышения активности трансаминаз. Повышение активности АЛТ/АСТ, более чем в 5 раз превышающее ВГН, наблюдалось у 0,7 % пациентов, получавших монотерапию тоцилизумабом, и у 1,4 % пациентов, получавших тоцилизумаб в комбинации с БПВП. При этом большинство пациентов навсегда прекратили терапию тоцилизумабом. Повышение активности печеночных трансаминаз не сопровождалось клинически значимым увеличением уровня прямого билирубина, а также клиническими проявлениями гепатита или печеночной недостаточности. Во время двойного слепого, контролируемого периода у пациентов, получавших лечение тоцилизумабом в дозе 8 мг/кг в комбинации с БПВП, частота превышения ВГН непрямого билирубина составила 6,2 %. В целом, у 5,8 % пациентов происходило увеличение уровня непрямого билирубина, в 1—2 раза превышающее ВГН, и у 0,4 % — более чем в 2 раза превышающее ВГН.
Во время двойного слепого контролируемого периода при долгосрочном применении характер и частота повышения активности АЛТ/АСТ соответствовали таковым, наблюдавшимся в 6-месячных контролируемых клинических исследованиях.
Показатели липидного обмена
Во время контролируемых исследований продолжительностью 6 месяцев часто сообщалось о повышении таких показателей липидного обмена, как общего холестерина, триглицеридов, холестерина ЛПНП и/или холестерина ЛПВП. Вместе с тем в ходе рутинного мониторинга лабораторных показателей было установлено, что приблизительно у 24 % пациентов, получавших препарат Актемра® во время клинических исследований, происходило устойчивое повышение общего холестерина в целом до уровня выше 6,2 ммоль/л, при этом у 15 % пациентов происходило устойчивое повышение показателя ЛПНП выше 4,1 ммоль/л. Показатели липидного обмена нормализовались при лечении гиполипидемическими препаратами.
Во время двойного слепого контролируемого периода при долгосрочном применении характер и частота повышения показателей липидного обмена соответствовали таковым, наблюдавшимся в 6-месячных контролируемых исследованиях.
Злокачественные новообразования
Клинических данных недостаточно, чтобы оценить возможную частоту развития злокачественных новообразований после использования тоцилизумаба. В настоящее время долгосрочная оценка безопасности продолжается.
Реакции со стороны кожи
Во время постмаркетингового использования сообщалось об очень редких случаях синдрома Стивенса-Джонсона.
Подкожное введение
РА
Безопасность подкожного введения препарата Актемра® при РА изучали в двойном слепом контролируемом, многоцентровом исследовании SC-I. SC-I было исследованием по доказательству отсутствия превосходства препарата активного контроля над исследуемым препаратом, в рамках которого сравнивали эффективность и безопасность введения препарата Актемра® в дозе 162 мг один раз в неделю с внутривенным введением препарата в дозе 8 мг/кг, с участием 1262 пациентов с РА. Все пациенты получали фоновую терапию небиологическим(и) БПВП. Безопасность и иммуногенность, наблюдавшиеся при подкожном введении препарата Актемра®, соответствовали таковым, указанным в имеющемся профиле безопасности препарата Актемра® для внутривенного введения, и новых или неожиданных нежелательных реакций на препарат не наблюдалось (смотрите таблицу 1). Более высокая частота реакций в месте инъекции наблюдалась в группе подкожного введения препарата по сравнению с таковой при подкожных инъекциях плацебо в группах внутривенного введения.
Реакции в месте инъекции
Во время 6-месячного контролируемого периода исследования SC-I частота развития реакций в месте инъекции составляла 10,1 % (64/631) и 2,4 % (15/631) при подкожном введении тоцилизумаба и плацебо (группа, получавшая препарат внутривенно) один раз в неделю, соответственно. Эти реакции в месте инъекции (включая покраснение кожи, зуд, боли и гематомы) были легкой и умеренной степени тяжести. Большинство реакций разрешились без терапевтического вмешательства и не требовали отмены препарата.
Иммуногенность
В 6-месячный контролируемый период исследования SC-I в целом 625 пациентов, получавших препарат Актемра® в дозе 162 мг один раз в неделю, были обследованы на формирование антител к препарату Актемра®. У пяти пациентов (0,8 %) зарегистрированы положительные результаты на антитела; у всех из них имели место нейтрализующие антитела к препарату Актемра®. У одного пациента зафиксирован положительный результат на изотип IgE (0,2 %).
В 6-месячный контролируемый период исследования SC-II в целом 434 пациента, получавших препарат Актемра® в дозе 162 мг один раз в две недели, были обследованы на наличие антител к тоцилизумабу. У семи пациентов (1,6 %) были положительные результаты на антитела к препарату Актемра®; из них у шести пациентов (1,4 %) образовались нейтрализующие антитела к препарату Актемра®. У четырех пациентов зарегистрирован положительный результат на изотип IgE (0,9 %). Взаимосвязи между образованием антител и клиническим ответом или нежелательными явлениями не наблюдалось.
Отклонения гематологических показателей от нормы
Нейтрофилы
Рутинный мониторинг лабораторных показателей во время контролируемого клинического исследования тоцилизумаба SC-I выявил снижение числа нейтрофилов ниже 1 109/л у 2,9 % пациентов, получавших препарат подкожно один раз в неделю.
Четкой связи между снижением уровня нейтрофилов ниже 1 109/л и развитием серьезных инфекций выявлено не было.
Тромбоциты
Рутинный мониторинг лабораторных показателей во время контролируемого клинического исследования SC-I не выявил снижения числа тромбоцитов до уровня 50 103/мкл и ниже ни у одного из пациентов, получавших препарат подкожно один раз в неделю.
Повышение активности печеночных трансаминаз
Рутинный мониторинг лабораторных показателей во время контролируемого клинического исследования SC-I выявил превышение ВГН уровня АЛТ или ACT более чем в 3 раза у 6,5 % и 1,4 % пациентов, получавших препарат подкожно один раз в неделю, соответственно.
Показатели липидного обмена
Рутинный мониторинг лабораторных показателей в контролируемом клиническом исследовании SC-I с подкожным введением препарата Актемра® один раз в неделю выявил устойчивое повышение показателя общего холестерина выше 6,2 ммоль/л (240 мг/дл) у 19 % пациентов, при этом у 9 % пациентов происходило устойчивое повышение ЛПНП, равное либо превышающее значение в 4,1 ммоль/л (160 мг/дл).
Подкожное введение
ГКА
Безопасность подкожного введения лекарственного средства Актемра® исследовалась в одном исследовании фазы III (WA28119) при участии 251 пациентов с ГКА. Общая продолжительность воздействия на пациентов препарата Актемра® в пациенто-годах составляла 138,5 пациенто-лет в течение 12-месячной двойной слепой плацебо-контролируемой фазы исследования. Общий профиль безопасности, наблюдавшийся для групп приема препарата Актемра®, согласовывался с известным профилем безопасности Актемра® (см. таблицу 1).
Инфекции
Показатель явлений инфекций / серьезных явлений инфекций был пропорционален между группой получения препарата Актемра® раз в неделю (200,2/9,7 явления на 100 пациенто-лет) и группами приема плацебо плюс 26 недель получения постепенно снижаемой дозы преднизона (156,0/4,2 явления на 100 пациенто-лет) и плацебо плюс 52 недели получения постепенно снижаемой дозы (210,2/12,5 явления на 100 пациенто-лет).
Реакции в месте инъекции
В группе подкожного введения препарата Актемра раз в неделю всего 6 % (6/100) пациентов сообщали о неблагоприятной реакции, развившейся в месте введения подкожной инъекции. Ни одна из реакций в месте введения препарата не описывалась как серьезное неблагоприятное явление и не требовала отмены лечения.
Иммуногенность
У одного пациента из группы подкожного введения препарата Актемра® раз в неделю (1,1 %, 1/95) появились положительные нейтрализующие антитела против препарата Актемра®, хотя они не принадлежали к изотипу иммуноглобулина E (IgE). У этого пациента ни реакция гиперчувствительности, ни реакция в месте введения не развивались.
Отклонения гематологических показателей от нормы
Нейтрофилы
В процессе рутинного лабораторного мониторинга в рамках 12-месячного контролируемого клинического испытания лекарственного средства Актемра® у 4 % пациентов из группы подкожного введения препарата Актемра® раз в неделю наблюдалось снижение уровня нейтрофилов ниже 1 109/л. Такое явление не наблюдалось ни в одной из групп получения плацебо плюс постепенно снижаемая доза преднизона.
Тромбоциты
В процессе рутинного лабораторного мониторинга в рамках 12-месячного контролируемого клинического испытания лекарственного средства Актемра® у одного пациента (1 %, 1/100) из группы подкожного введения препарата Актемра® раз в неделю наблюдалось однократное преходящее снижение уровня тромбоцитов до < 100 103/мкл без ассоциируемых явлений кровотечения. Снижение уровня тромбоцитов ниже 100 103/мкл не наблюдалось ни в одной из групп получения плацебо плюс постепенно снижаемая доза преднизона.
Повышение активности печеночных трансаминаз
В процессе рутинного лабораторного мониторинга в рамках 12-месячного контролируемого клинического испытания лекарственного средства Актемра® увеличение уровня АЛТ ≥ 3 х верхняя граница нормы (ВГН) наблюдалось у 3 % пациентов из группы подкожного введения препарата Актемра® раз в неделю в сравнении с 2 % пациентов из группы получения плацебо плюс 52 недели получения постепенно снижаемой дозы преднизона и отсутствием пациентов из группы плацебо плюс 26 недель получения постепенно снижаемой дозы преднизона. Увеличение уровня ACT > 3 ВГН наблюдалось у 1 % пациентов из группы подкожного введения препарата Актемра® раз в неделю в сравнении с отсутствием пациентов из групп приема плацебо плюс постепенно снижаемая доза преднизона.
Показатели липидного обмена
В процессе рутинного лабораторного мониторинга в рамках 12-месячного контролируемого клинического испытания лекарственного средства Актемра® у 34 % пациентов из группы подкожного введения препарата Актемра® раз в неделю отмечалось устойчивое повышение общего холестерина > 6,2 ммоль/л (240 мг/дл), при этом у 15 % из них наблюдалось устойчивое увеличение липопротеина низкой плотности (ЛПНП) до ≥ 4,1 ммоль/л (160 мг/дл).
Подкожное введение
пЮИА
Профиль безопасности лекарственного средства Актемра® также оценивался у 52 пациентов детского возраста с пЮИА. Общая подверженность пациентов воздействию препарата Актемра® во всей популяции с пЮИА, подвергавшейся воздействию, составляла 184,4 для в/в формы и 50,4 пациенто-лет для п/к формы тоцилизумаба. В целом профиль безопасности, описанный для пациентов пЮИА, соответствовал известному профилю безопасности препарата Актемра®, за исключением ИР (см. таблицу 1). С большей частотой реакций в месте инъекции (ИР) после п/к введения Актемра® отмечались у пациентов пЮИА в сравнении с взрослыми пациентами с РА.
Инфекции
В исследовании п/к формы лекарственного средства Актемра® показатель инфекции у пациентов с пЮИА, получавших лечение п/к Актемра®, был сопоставим с показателем у пациентов с пЮИА, получавших лечение в/в Актемра®.
Реакции в месте инъекции
Всего 28,8 % (15/52) пациентов с пЮИА испытывали ИР после получения п/к Актемра®. Эти ИР развивались у 44 % пациентов с массой тела ≥ 30 кг в сравнении с 14,8 % пациентов с массой тела менее 30 кг. Наиболее частыми ИР были эритема в месте инъекции, опухание, гематома, боль и зуд. Все отмеченные ИР относились к несерьезным явлениям 1 степени, и ни одна из ИР не требовала отмены лечения пациента или прерывания дозирования.
Иммуногенность
В исследовании п/к формы у 5,8 % [3/52] субъектов развились положительные нейтрализующие антитела к тоцилизумабу без серьезной или клинически значимой реакции гиперчувствительности. 1 пациент из этих 3 впоследствии вышел из исследования. Не наблюдалось никакой связи между появлением антител и клиническим откликом или неблагоприятными явлениями.
Отклонения гематологических показателей от нормы
В течение регулярного лабораторного мониторинга во всей популяции, подвергавшейся воздействию препарата Актемра®, снижение уровня нейтрофилов менее 1 109/л происходило у 15,4 % пациентов, получавших п/к форму Актемра®. Увеличение значений АЛТ или ACT ≥ 3 ВГН отмечалось у 9,6 % и 3,8 % пациентов, получавших п/к форму Актемра®, соответственно. Ни у одного из пациентов, получавших лечение п/к формой Актемра®, не отмечалось снижения уровня тромбоцитов до ≤ 50 103/мкл.
Показатели липидного обмена
В исследовании п/к формы у 14,3 %> и 12,8 % пациентов отмечалось увеличение уровня холестерина липопротеинов низкой плотности (ЛПНП) до ≥ 130 мг/дл по сравнению с базовым уровнем, а также общего уровня холестерина до ≥ 200 мг/дл в любой момент в течение периода лечения в рамках исследования соответственно.
Противопоказания Актемра
Повышенная чувствительность к действующему веществу или любому вспомогательному веществу, указанному в разделе «Перечень вспомогательных веществ».
Тяжелые инфекционные заболевания, находящиеся в активной стадии (смотрите раздел «Особые указания и меры предосторожности при применении»).
Передозировка
Имеются ограниченные данные о передозировке препаратом Актемра®. Сообщалось об одном случае непреднамеренной передозировки препаратом, при этом пациент с множественной миеломой получил однократную дозу 40 мг/кг препарата внутривенно. Нежелательных реакций не наблюдалось.
У здоровых добровольцев, получавших препарат однократно в дозе до 28 мг/кг, серьезных нежелательных реакций также не наблюдалось, хотя имела место нейтропения, которая требовала ограничения дозы.
Меры предосторожности
Прослеживаемость
В целях улучшения прослеживаемости биологических лекарственных препаратов следует четко регистрировать наименование и серию введенного препарата.
Инфекции
У пациентов, получавших иммуносупрессанты, в том числе препарат Актемра® сообщалось о развитии серьезных инфекционных заболеваний, иногда с летальным исходом (смотрите раздел «Нежелательные реакции»). Не следует начинать терапию препаратом Актемра® в случае активных инфекционных заболеваний (смотрите раздел «Противопоказания»). При развитии серьезных инфекций введение препарата Актемра® должно быть прервано до устранения инфекции (смотрите раздел «Нежелательные реакции»). Работникам здравоохранения следует соблюдать осторожность при использовании препарата Актемра® у пациентов с рецидивирующими или хроническими инфекционными заболеваниями в анамнезе, а также с сопутствующими заболеваниями (например, при дивертикулите, сахарном диабете и интерстициальном заболевании легких), предрасполагающих к развитию инфекций.
Рекомендуется проявлять осторожность с целью раннего выявления серьезных инфекционных заболеваний у пациентов, получающих лечение иммуносупрессивными препаратами, такими ка препарат Актемра®, с РА средней и тяжелой степени, пЮИА или ГКА, поскольку признаки или симптомы острого воспаления могут быть менее выраженными в связи с подавлением реакции острой фазы. При оценке риска развития инфекционного заболевания следует учитывать действие тоцилизумаба на С-реактивный белок (СРБ), нейтрофилы, а также признаки и симптомы инфекционного заболевания. Пациентов следует проинформировать о необходимости сразу обратиться к работнику здравоохранения при любых симптомах, свидетельствующих о появлении инфекции, с целью своевременной диагностики и назначения необходимого лечения.
Туберкулез
До начала терапии препаратом Актемра®, как и при назначении других биологических препаратов, рекомендуется провести обследование всех пациентов на наличие латентного туберкулеза (ТБ). Пациентам с латентным ТБ следует назначить стандартный курс антимикобактериальной терапии перед началом лечения препаратом Актемра®. Лечащие врачи должны помнить о существовании риска ложноотрицательных результатов туберкулиновых кожных проб и определении гамма-интерферона в крови для диагностики ТБ, особенно у тяжелобольных пациентов или пациентов с иммунодефицитом.
Пациентов следует инструктировать о необходимости обратиться за медицинской помощью в случае, если во время или после завершения терапии препаратом Актемра® развиваются характерные для туберкулеза признаки/симптомы (например, непрекращающийся кашель, истощение / потеря веса, субфебрильная температура тела).
Реактивация вирусных инфекций
У пациентов с РА, получавших терапию биологическими препаратами, сообщалось о случаях реактивации вирусной инфекции (например, вирусного гепатита В). Пациентов, имевших положительный результат при скрининговом обследовании на гепатит, исключали из клинических исследований тоцилизумаба.
Осложнения дивертикулита
У пациентов, получавших препарат Актемра®, нечасто сообщалось о случаях перфорации дивертикула, как осложнения дивертикулита (смотрите раздел «Нежелательные реакции»). Следует соблюдать осторожность при применении препарата Актемра® у пациентов с язвенным поражением желудочно-кишечного тракта (ЖКТ) или дивертикулитом в анамнезе. Пациенты с подозрением на осложненный дивертикулит (например, с болями в области живота, кровотечениями и/или необъяснимым изменением ритма опорожнения кишечника с лихорадкой), должны быть немедленно обследованы с целью раннего выявления дивертикулита с перфорацией ЖКТ.
Реакции гиперчувствительности
В связи с применением препарата Актемра® сообщалось о серьезных реакциях гиперчувствительности, включая анафилаксию (смотрите раздел «Нежелательные реакции»). Такие реакции могут быть более тяжелыми и иметь большую вероятность фатального исхода, если реакции гиперчувствительности имели место во время предшествующего лечения тоцилизумабом, даже в случае премедикации кортикостероидами и антигистаминными лекарственными средствами. При возникновении анафилактической реакции или другой серьезной реакции гиперчувствительности, следует немедленно остановить и не возобновлять введение препарата Актемра® в дальнейшем, а также назначить соответствующую терапию.
Активное заболевание печени и печеночная недостаточность
Лечение препаратом Актемра®, особенно одновременно с МТ, может быть сопряжено с повышением активности печеночных трансаминаз, поэтому при назначении лечения следует проявлять осторожность у пациентов с активным заболеванием печени или печеночной недостаточностью (смотрите разделы «Режим дозирования и способ применения» и «Нежелательные реакции»).
Повышение активности печеночных трансаминаз
В клинических исследованиях при лечении препаратом Актемра® часто сообщалось о транзиторном или интермиттирующем легком и умеренном повышении активности печеночных трансаминаз без развития повреждения печени (смотрите раздел «Нежелательные реакции»). Повышение частоты возникновения подобных изменений наблюдалась при использовании препарата Актемра® совместно с потенциально гепатотоксическими препаратами (например, МТ). При наличии клинических показаний следует определить другие биохимические показатели функции печени, в том числе билирубин. Следует соблюдать осторожность при решении вопроса о начале лечения препаратом Актемра® у пациентов с показателем АЛТ или ACT, превышающем ВГН более чем в 1,5 раза. Не рекомендуется проводить лечение препаратом Актемра®, если показатели АЛТ или ACT исходно превышают ВГН более чем в 5 раз.
У пациентов с РА и ГКА следует мониторировать показатели АЛТ и ACT каждые 4—8 недель на протяжении первых 6 месяцев лечения, а в дальнейшем — каждые 12 недель. Рекомендации по коррекции доз в зависимости от активности трансаминаз смотрите в разделе «Режим дозирования и способ применения». При превышении ВГН АЛТ или ACT в 3—5 раз — следует прервать лечение препаратом Актемра®.
У пациентов с пЮИА уровень АЛТ и ACT должен контролироваться в момент второго введения и впоследствии согласно требованиям надлежащей клинической практики (см. раздел «Режим дозирования и способ применения»).
Отклонения гематологических показателей от нормы
На фоне лечения тоцилизумабом в дозе 8 мг/кг в комбинации с МТ было отмечено снижение числа нейтрофилов и тромбоцитов (смотрите раздел «Нежелательные реакции»). У пациентов, ранее получавших лечение антагонистами ФНО, возможен повышенный риск развития нейтропении.
У пациентов, ранее не получавших лечение препаратом Актемра®, не рекомендуется начинать лечение при АЧН ниже 2 109/л. Следует соблюдать осторожность при назначении лечения препаратом Актемра® у пациентов с низким числом тромбоцитов (т. е. число тромбоцитов ниже 100 103/мкл). Не рекомендуется продолжать лечение у пациентов с АЧН ниже 0,5 109/л или числом тромбоцитов менее 50 103/мкл.
Тяжелая нейтропения может быть связана с повышенным риском развития серьезных инфекций, хотя на сегодняшний день в клинических исследованиях препарата Актемра® явной связи между снижением числа нейтрофилов и развитием серьезных инфекций показано не было.
У пациентов с РА и ГКА следует контролировать число нейтрофилов и тромбоцитов через 4—8 недель от начала терапии, а в дальнейшем в соответствии со стандартной клинической практикой. Информацию по коррекции доз в зависимости от АЧН и числа тромбоцитов смотрите в разделе «Режим дозирования и способ применения».
У пациентов с пЮИА следует контролировать число нейтрофилов и тромбоцитов в момент второго введения и впоследствии согласно требованиям надлежащей клинической практики (см. раздел «Режим дозирования и способ применения»).
Показатели липидного обмена
Наблюдалось повышение показателей липидного обмена, в том числе общего холестерина, липопротеина низкой плотности (ЛПНП), липопротеина высокой плотности (ЛПВП), триглицеридов, у пациентов, получавших лечение тоцилизумабом (смотрите раздел «Нежелательные реакции»). У большинства пациентов, ответивших на лечение гиполипидемическими средствами, повышения индекса атерогенности и показателей общего холестерина не было.
У всех пациентов показатели липидного обмена следует оценивать через 4—8 недель после начала терапии препаратом Актемра®. При ведении пациентов следует руководствоваться национальными клиническими рекомендациями по лечению гиперлипидемии.
Неврологические нарушения
Врачам следует быть внимательными в отношении возможных симптомов впервые развивающихся демиелинизирующих заболеваний ЦНС. В настоящее время способность препарата Актемра® вызывать демиелинизирующие заболевания ЦНС не известна.
Злокачественные новообразования
Пациенты с РА находятся в группе риска развития злокачественных новообразований. Иммуномодулирующие препараты могут увеличивать риск развития злокачественных образований.
Иммунизация
Не следует проводить иммунизацию живыми и ослабленными вакцинами одновременно с терапией препаратом Актемра®, поскольку клиническая безопасность подобного сочетания не установлена. В рандомизированном открытом исследовании взрослые пациенты с РА, получавшие лечение препаратом Актемра® совместно с МТ, достигали эффективного ответа как на 23-валентный пневмококковый полисахарид, так и на противостолбнячные вакцины, который был аналогичен таковому при монотерапии МТ. Рекомендуется, чтобы до начала лечения препаратом Актемра® все пациенты, особенно дети и пожилые пациенты, прошли вакцинацию в соответствии с действующими рекомендациями по иммунизации. Следует соблюдать интервал между иммунизацией живыми вакцинами и началом терапии препаратом Актемра® в соответствии с действующими рекомендациями по иммунизации при терапии иммуносупрессивными препаратами.
Риск развития сердечно-сосудистых заболеваний
Пациенты с РА находятся в группе риска развития сердечно-сосудистых заболеваний; факторы риска (такие как гипертензия, гиперлипидемия) следует контролировать согласно установленным стандартам.
Комбинация с антагонистами ФНО
У пациентов с РА препарат Актемра® не применялся одновременно с антагонистами ФНО или другими биологическими препаратами. Не рекомендуется применять препарат Актемра® одновременно с другими биологическими препаратами.
ГКА
Монотерапия препаратом Актемра® не должна использоваться для лечения острых рецидивов, поскольку эффективность в этой ситуации установлена не была. Глюкокортикоиды следует назначать в соответствии с медицинской оценкой и практическим руководством.
Дети
Безопасность и эффективность применения препарата Актемра® для подкожных инъекций у новорожденных и детей младше 2 лет не установлены. Данные отсутствуют.
Применение в период беременности и кормления грудью
Женщины детородного возраста
Женщинам детородного возраста следует использовать надежные средства контрацепции во время терапии и в течение 3 месяцев после завершения лечения.
Беременность
Достаточных данных по применению лекарственного средства Актемра® у беременных женщин нет. В исследовании на животных было показано, что при приеме препарата в высоких дозах повышается риск спонтанного выкидыша / смерти эмбриона или плода (смотрите раздел « Доклинические данные по безопасности»). Потенциальный риск для человека неизвестен.
Не следует принимать препарат Актемра® во время беременности при отсутствии очевидной необходимости.
Период грудного вскармливания.
Неизвестно, выводится ли тоцилизумаб с грудным молоком у человека. Выведение лекарственного средства Актемра® с грудным молоком у животных не изучалось. При принятии решения о продолжении/прерывании грудного вскармливания и продолжении/прерывании терапии препаратом Актемра® следует принимать во внимание пользу грудного вскармливания для ребенка и пользу терапии для матери.
Фертильность
Имеющиеся доклинические данные свидетельствуют о том, что во время лечения лекарственным средством Актемра® влияния на фертильность не происходит.
Способность влиять на скорость реакции при управлении транспортом
Препарат Актемра® незначительно влияет на способность к вождению транспортных средств и управлению механизмами (смотрите раздел «Нежелательные реакции», головокружение).
Взаимодействие с другими лекарственными средствами
Исследования по лекарственному взаимодействию проводились только у взрослых пациентов.
Одновременное однократное введение препарата Актемра® в дозе 10 мг/кг и МТ в дозе 10—25 мг 1 раз в неделю не оказывало клинически значимого влияния на концентрацию МТ. Популяционные фармакокинетические анализы не выявили какого-либо воздействия МТ, нестероидных противовоспалительных препаратов (НПВП) или кортикостероидов на клиренс препарата Актемра® у пациентов с РА. У пациентов с ГКА не наблюдалось влияния общей дозы кортикостероидов на воздействие лекарственного средства Актемра®.
Экспрессия печеночных изоферментов CYP450 подавляется действием цитокинов, например ИЛ-6, которые стимулируют хроническое воспаление. Поэтому при проведении терапии средствами, ингибирующими действие цитокинов, например препаратом Актемра®, экспрессия изоферментов CYP450 может быть изменена.
В исследованиях in vitro, проведенных на культуре гепатоцитов человека, было показано, что ИЛ-6 вызывает снижение экспрессии изоферментов CYP1A2, CYP2C9, CYP2C19 и CYP3A4. Препарат Актемра® нормализует экспрессию этих изоферментов.
В одном из исследований через одну неделю после однократного введения тоцилизумаба у пациентов с РА концентрация симвастатина (субстрат CYP3A4) снижалась на 57 %, т. е. до концентрации, которая была такой же или незначительно выше, как у здоровых добровольцев.
В начале или при завершении курса терапии тоцилизумабом следует тщательно наблюдать за пациентами, получающими лекарственные средства в индивидуально подобранных дозах, и которые метаболизируются посредством изоферментов CYP450 3A4, 1А2 или 2С9 (например, метилпреднизолон, дексаметазон (с возможным развитием синдрома отмены перорально применяемых глюкокортикоидов), аторвастатин, блокаторы «медленных» кальциевых каналов, теофиллин, варфарин, фенпрокумон, фенитоин, циклоспорин или бензодиазепины), поскольку для обеспечения терапевтического действия этих препаратов может потребоваться увеличение их дозы. Учитывая длительный период полувыведения (T1/2) тоцилизумаба, его действие на активность изоферментов CYP450 может сохраняться в течение нескольких недель после прекращения терапии.
Условия и срок хранения Актемра
24 месяца.
После того, как препарат Актемра® взят из холодильника, его следует ввести в течение 8 часов и не хранить при температуре выше 30 °C.
Хранить при температуре 2—8 °C в защищенном от света месте. Не замораживать.
Хранить в недоступном для детей месте.
Упаковка
По 162 мг/0,9 мл препарата в шприц-тюбик (из стекла класса I) с несъемной иглой. Шприц закрыт при помощи твердого защитного колпачка (уплотнение из эластомера с полипропиленовой оболочкой) и уплотнителя (из бутилкаучука с фторкаучуковым покрытием). 4 шприц-тюбика помещают в картонную пачку вместе с инструкцией по применению.
Особые меры предосторожности при обращении с препаратом и его утилизации
Препарат Актемра® поставляется в одноразовых шприц-тюбиках, оснащенных защитной крышечкой для иглы. После того, как шприц-тюбик взят из холодильника, перед инъекцией препарата Актемра® необходимо дать ему нагреться до комнатной температуры (18—28 °C) в течение 25—30 минут. Шприц не встряхивать! После снятия колпачка необходимо сделать инъекцию в течение 5 минут, чтобы предотвратить высыхание препарата и забивания иглы. Если шприц-тюбик не используется в течение 5 минут после снятия колпачка, необходимо убрать его в контейнер, защищающий от колющих предметов, и использовать новый шприц-тюбик.
Если после ввода иглы уплотнитель не поддается нажиму, уберите шприц-тюбик в контейнер, защищающий от колющих предметов, и используйте новый шприц-тюбик.
Не использовать препарат, если: он мутный или содержит твердые частицы, его цвет отличен от бесцветного или желтоватого цвета, часть шприц-тюбика кажется поврежденной.
Подробные инструкции по введению препарата Актемра® в шприц-тюбиках представлены ниже.
Неиспользованный лекарственный препарат или его отходы должны быть уничтожены в соответствии с национальными требованиями.
Правила отпуска
По рецепту.
Информация о производителе
Владелец регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070 Basel, Switzerland
Производитель
Веттер Фарма-Фертигунг ГмбХ и Ко.КГ, Германия
Vetter Pharma-Fertigung GmbH & Со KG, D-88214 Ravensburg, Germany
В случае поставок и реализации на территории Республики Беларусь претензии потребителей направлять на адрес ИООО «Рош Продактс Лимитед»:
220073, г. Минск, 1-й Загородный пер., 20, 8-й этаж, кабинет 20.
Тел. (017) 256 23 08; факс (017) 256 23 06.
Дальнейшая информация
Помните, храните эти и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте Актемра только по назначению врача.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, которая отображается на этой странице, может быть применена к вашим личным обстоятельствам.
Внимание! Эта инструкция по применению лекарственного средства является официальной инструкцией производителя F.Hoffmann-La Roche Ltd, Швейцария manufactured by Vetter Pharma-Fertigung GmbH & Co. KG.
Авторское право:
- F.Hoffmann-La Roche Ltd, Швейцария manufactured by Vetter Pharma-Fertigung GmbH & Co. KG
- https://www.rceth.by - Государственный реестр ЛС Республики Беларусь
| Тип данных | Сведения из реестра |
| Торговое наименование: | Актемра |
| Форма выпуска: | раствор для подкожного введения 162мг/0,9мл в шприц-тюбике с несъемной иглой в упаковке №4 |
| Международное наименование: | Tocilizumab |
| Производитель: | F.Hoffmann-La Roche Ltd, Швейцария manufactured by Vetter Pharma-Fertigung GmbH & Co. KG, Германия |
| Заявитель: | F.Hoffmann-La Roche Ltd, Швейцария |
| Номер регистрации: | 10327/15/17/20 |
| Дата регистрации: | 13.04.2020 |
| Срок действия: | бессрочно |
| Дата переоформления: | 01.01.2100 |
| Тип: | Иммунобиологическое лекарственное средство |
| Оригинальное: | оригинальное |
| Состав лекарственного средства: | Tocilizumab |
| Код АТХ: | L04AC07 |
| Производитель готовой лекарственной формы: | Vetter Pharma-Fertigung GmbH & Co. KG, Германия |
| Производитель, осуществляющий фасовку/упаковку: | Vetter Pharma-Fertigung GmbH & Co. KG, Германия (фасовка), F.Hoffmann-La Roche Ltd, Швейцария (упаковка) |
| Контроль качества: | |
| Выдача разрешения на выпуск лекарственного средства: | F.Hoffmann-La Roche Ltd, Швейцария |
| Другие участники производства: | F.Hoffmann-La Roche Ltd, Швейцария (выпуск серии) |
| Заявленная цена: | 1500USD |
| Порядок отпуска: | по рецепту |
| Список хранения: | |
| Срок годности лекарства: | 2 года |
| Нормативная документация: | НД РБ 8942-2020 |
| Дата утверждения нормативной документации: | 13 апреля 2020 г. 0:00 |
| Срок действия нормативной документации: | |
| Изменение в нормативной документации: | |
| Номер разрешения НД: | 10645 |
| Код АТХ | Название группы |
| L | Противоопухолевые препараты и иммуномодуляторы |
| L04 | Иммунодепрессанты |
| L04A | Иммунодепрессанты |
| L04AC | Ингибиторы интерлейкина |
| L04AC07 | Tocilizumab |
